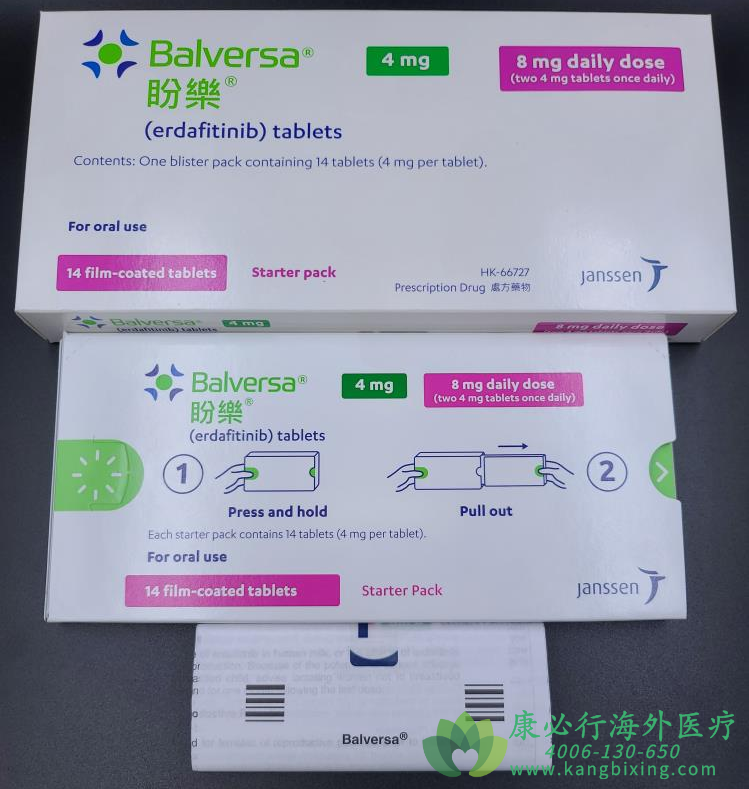
FDA批准强生旗下杨森制药的厄达替尼(Balversa)上市,用于治疗FGFR3或FGFR2基因改变、铂基化疗后疾病仍然进展的局部晚期或转移性膀胱癌成年患者。
厄达替尼是一种每日一次的口服泛FGFR酪氨酸激酶抑制剂,也是首个获批用于转移性膀胱癌的靶向疗法。FDA指出,该药在使用前应使用经批准的配套诊断设备,以确定患者是否适用。因此,QIAGEN therascreen FGFR RGQ逆转录聚合酶链反应试剂盒同时获批作为与 厄达替尼的辅助诊断试剂。
厄达替尼的加速批准基于一项二期临床试验BLC2001的结果。试验中,厄达替尼诱导局部晚期或转移性膀胱癌患者的总应答率(ORR)为32.2%,包括2.3%的完全应答率和29.9%的部分应答率。其中有一部分是先前对PD-1/PD-L1治疗无反应的患者。
BLC2001是一项开放标签、单臂、多中心的临床试验,包括87例转移性或手术不可切除性尿路上皮癌伴FGFR基因组改变的患者。经中心实验室证实,患者有FGFR3基因突变(R248C、S249C、 G370C、Y373C)或FGFR基因融合(FGFR3-TACC3、FGFR3-BAIAP2L1、FGFR2-BICC1、FGFR2-CASP7)。此外,所有患者在先前的化疗后或化疗时都有疾病进展。患者中位年龄为67岁(36-87),74%为白人,79%为男性。92%的ECOG表现为0或1,66%的患者有内脏转移。24%的患者先前接受过PD-1/PD-L1抑制剂,几乎所有(97%)的患者都曾接受过顺铂或卡铂治疗,其中10%同时接受过顺铂和卡铂的治疗。3名患者在仅接受含铂新辅助治疗或辅助治疗后有进展。
患者使用厄达替尼的初始剂量为每天8毫克。在14和17天之间,血清磷酸盐水平低于5.5 mg/dL的患者(占41%)剂量增加到每天9毫克。响应的中位持续时间为5.4个月。64例FGFR3基因点突变患者的ORR为40.6%,18例FGFR3融合患者的ORR为11.1%。6例FGFR2融合患者均无明确反应。
治疗中最常见的不良事件包括:磷酸盐升高(76%)、口炎(56%)、疲劳(54%)、肌酐升高(52%)、腹泻(47%)、口干(45%)、尿崩症(41%)、谷丙转氨酶升高(41%)、食欲下降(38%)、白蛋白降低(37%)、呼吸困难(37%)等。3级及以上不良事件包括甲亢(10%)、口炎(9%)、掌跖红细胞感觉异常综合征(6%)和甲沟炎(3%)。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 厄达替尼 https://www.kangbixing.com/drug/edatini/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问