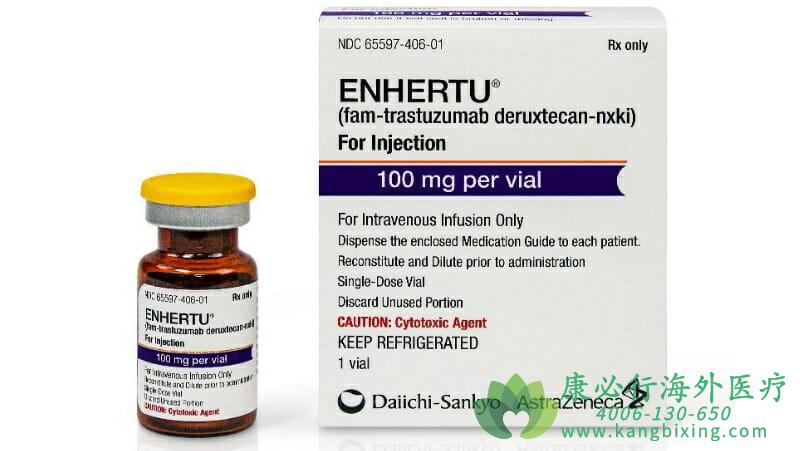
美国当地时间2022年8月5日,FDA批准了著名的ADC药物Enhertu(fam-trastuzumab-deruxtecan-nxki,DS-8201)通过静脉输液的方式治疗无法切除或转移性HER2低表达(HER2-low)乳腺癌患者。这是首个获批针对HER2低表达乳腺癌亚型患者的疗法,该亚型是新定义的HER2阴性乳腺癌亚型。
该批准基于DESTINY-Breast04,一项随机、多中心、开放标签的临床试验。该试验招募了557名患有不可切除或转移性HER2低表达乳腺癌成年患者,包括两个队列:494名激素受体阳性(HR+)患者和63名激素受体阴性(HR-)患者。在这些患者中,373名随机接受Enhertu每三周静脉输注一次,184名随机接受医生选择的化疗(艾日布林、卡培他滨、吉西他滨、白蛋白紫杉醇或紫杉醇)。结果显示,不可切除或转移性HER2低表达乳腺癌患者的无进展生存期和总生存期均有所改善。
试验参与者的中位年龄为57岁,从28岁到81岁不等。在557名患者中,24%的患者年龄在65岁或以上。女性占试验人群的99.6%。据报道,试验参与者的种族为48%的白人、40%的亚洲人、2%的黑人或非裔美国人以及3.8%的西班牙裔/拉丁裔。
在DESTINY-Breast04中接受Enhertu的患者最常见的不良反应是恶心、疲劳、脱发、呕吐、便秘、食欲下降、肌肉骨骼疼痛和腹泻。处方信息包括一个黑框警告,以告知医疗保健专业人员间质性肺病和胚胎-胎儿毒性的风险。不建议孕妇使用Enhertu。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 Enhertu https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问