FDA批准胃肠道间质瘤新疗法;一项开放标签、剂量递增/剂量扩展的Ⅰ期研究,评估阿维普替尼用于不可切除或转移性GIST患者的安全性和疗效。《欧洲癌症杂志》(European Journal of Cancer,EJC)全文发表了NAVIGATOR研究针对PDGFRA D842V突变GIST患者的更新数据,38例起始剂量为300/400mg的患者中,36例缓解,ORR高达95%。28例起始剂量为300mg的患者中,27例缓解,ORR为96%,所有剂量组的疾病控制率(DCR)高达100%。所有剂量组的中位DOR长达27.6个月。最常见的治疗相关不良事件(AE)是贫血、胆红素增高、白细胞下降、肌酸磷酸激酶增加、天冬氨酸转氨酶增加、面部水肿、眶周水肿、中性粒计数下降、发色改变等。再次夯实了阿伐替尼的稳健、持久、高效的临床获益,且安全性可控。
基石药业与Blueprint Medicines公司达成独家合作和授权协议,获得了包括阿维普替尼在内的多款药物在大中华地区(包括中国大陆、香港、澳门和台湾地区)的独家开发和商业化授权。Blueprint Medicines将保留全球其他地区的开发和商业化权利。
关于胃肠道间质瘤(GIST)
GIST是发生于胃肠道的肉瘤,肉瘤是发生在骨内或源自结缔组织的肿瘤。胃肠道间质瘤起源于胃肠道壁中的细胞,并且最常发生在胃或小肠中。大多数患者的确诊年龄在50至80岁之间,通常在胃肠道出血、做手术或医学影像检查时发现,极少在肿瘤破裂或胃肠道发生梗阻后确诊。原发GIST中,约有5%至6%的病例由PDGFRA D842V突变导致,这种突变是最常见的PDGFRA外显子18突变。
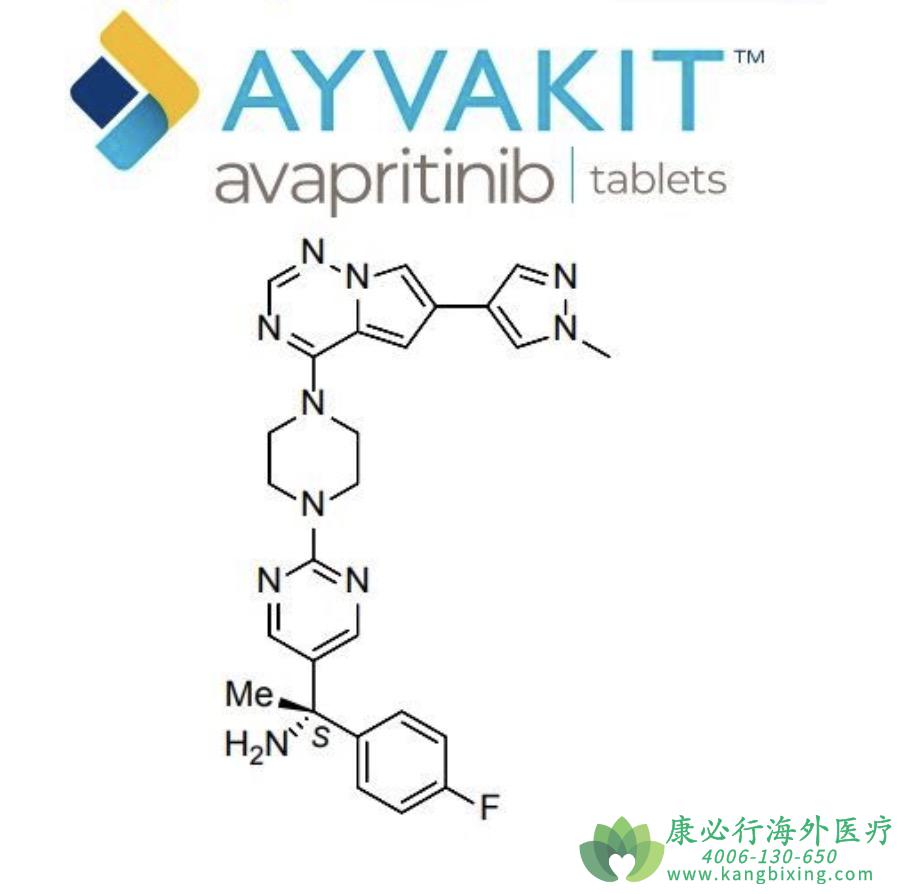
关于阿维普替尼(avapritinib)
阿维普替尼是一种激酶抑制剂,中国香港卫生署批准其以商品名阿维普替尼上市销售,用于治疗携带PDGFRA D842V突变无法切除或转移性胃肠道间质瘤成人患者。中国国家药品监督管理局(NMPA)批准其以商品名泰吉华®上市销售,用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的不可切除性或转移性GIST成人患者。台湾食品药物管理署批准其以商品名泰時维®上市销售,用于治疗携带PDGFRA D842V突变无法切除或转移性胃肠道间质瘤成人患者。
美国食品药品监督管理局批准其以商品名阿维普替尼上市销售,用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的不可切除性或转移性GIST成人患者以及治疗晚期系统性肥大细胞增多症(advanced SM)成人患者,包括侵袭性SM(ASM)、伴有血液肿瘤的SM(SM-AHN)和肥大细胞白血病(MCL)。欧盟委员会批准其以商品名AYVAKYT®上市销售,用于治疗携带PDGFRA D842V突变无法切除或转移性胃肠道间质瘤成人患者。阿维普替尼在大中华地区、美国、欧盟还未获批用于其他适应症,或者其他地区的医疗监管机构还未对阿维普替尼的任何适应症做出批准决定。
全球范围内,Blueprint Medicines针对阿维普替尼治疗晚期和惰性系统性肥大细胞增生症(SM)患者的临床开发正在进行。美国FDA已授予阿维普替尼突破性疗法认定,用于治疗晚期SM,包括侵袭性SM的亚型,以及伴有相关血液肿瘤和肥大细胞白血病的SM,以及中度至重度惰性SM。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 阿维普替尼 https://www.kangbixing.com/drug/awptn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问












