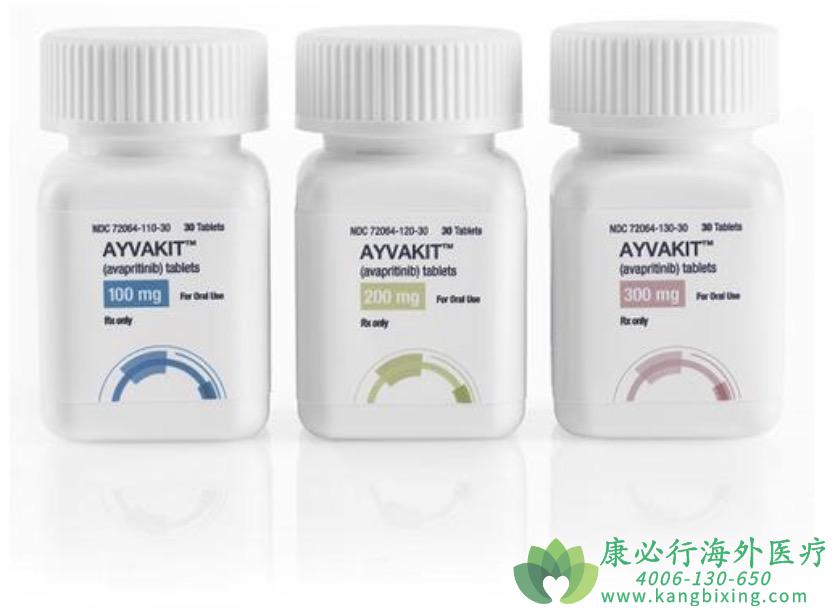
阿维普替尼,又称阿伐普替尼或AYVAKIT,由Blueprint Medicines公司研发,并于2020年1月9日获得美国食品药品监督管理局(FDA)批准上市,用于治疗携带血小板源性生长因子受体α(PDGFRA)基因18外显子突变的不可手术或转移性成人GIST患者,其中特别包括PDGFRA D842V位点突变的患者。这一药物以其高活性和高选择性在临床试验中表现突出,成为GIST治疗领域的重要突破。
阿维普替尼在临床试验中的安全性表现
安全性数据
在多项临床试验中,阿维普替尼的安全性得到了全面评估。根据ESMO GI 2021线上年会公布的数据,截至2020年7月31日,共有60例患者纳入阿维普替尼的安全性评估。研究结果显示,阿维普替尼治疗最常见的不良反应包括贫血、胆红素增高、白细胞下降、肌酸磷酸激酶增加、天冬氨酸转氨酶增加、面部水肿、眶周水肿、中性粒细胞计数下降、发色改变等。这些不良反应多为轻至中度,且多数患者能够耐受。
在另一项开放标签、多中心、单臂I期临床研究(代号NAVIGATOR)中,38例携带PDGFRA D842V突变的患者接受阿维普替尼治疗后,其不良反应主要包括水肿、恶心、疲劳、认知功能损伤、呕吐、食欲下降、腹泻等。然而,这些不良反应并未导致大多数患者停药,显示了阿维普替尼良好的安全性和耐受性。
剂量调整与特殊人群
阿维普替尼的推荐口服剂量为300mg,每日一次,且应在餐前1小时和餐后2小时空腹给药。对于出现不良反应的患者,可根据具体情况进行剂量调整,以降低不良反应的严重程度。此外,对于特定人群如老年患者、肝损害患者和肾损害患者,虽然目前的数据有限,但一般建议在医生指导下慎用,并根据患者的具体情况调整剂量。
阿维普替尼的临床疗效
阿维普替尼不仅在安全性方面表现出色,其临床疗效同样令人瞩目。在PDGFRA外显子18突变的治疗组中,患者的总缓解率(ORR)达到了86.0%,临床受益率(CBR)为95.3%。对于四线及以上的GIST患者,阿维普替尼同样展示了良好的治疗潜力,ORR达到17%,CBR达到52%,中位无进展生存期(mPFS)达到5.6个月。这些数据表明,阿维普替尼在治疗GIST方面具有显著的抗肿瘤活性。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 阿维普替尼 https://www.kangbixing.com/drug/awptn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问