10月9日,信达生物宣布,其与美国礼来制药共同开发的抗肿瘤药物达伯华®正式获得国家药品监督管理局的上市批准。这是继达伯舒®、达攸同®、苏立信®之后信达生物第4个获批上市的单克隆抗体药物。信达生物因此成为中国拥有单抗药品上市数量最多的制药企业。
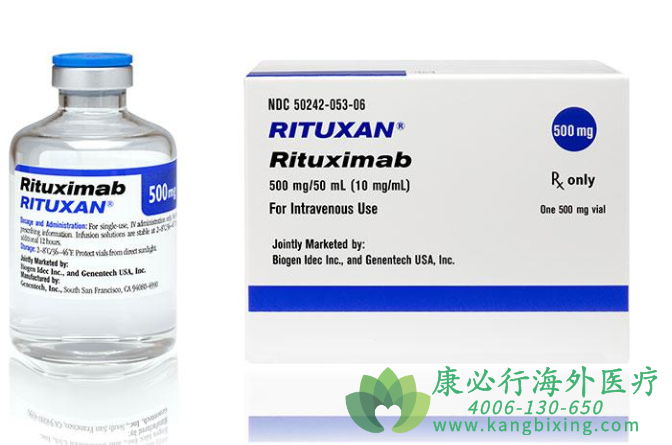
达伯华®为利妥昔单抗注射液生物类似药,又名重组抗CD20单克隆抗体注射液,利妥昔单抗是一种单克隆抗体,可与B淋巴细胞表面的CD20抗原结合,介导补体依赖性细胞毒作用(CDC)和抗体依赖性细胞介导的细胞毒作用(ADCC),介导体内正常及恶性B细胞溶解,从而实现抗肿瘤治疗效果。
利妥昔单抗的原研药是美罗华,是由罗氏基因泰克Genentech公司原研并由FDA批准的第一个用于治疗癌症的单克隆抗体。1997年11月,利妥昔单抗获FDA批准在美国上市成为罗氏重磅药品。
利妥昔单抗自上市以来,在欧美已获批的适应症有:非霍奇金淋巴瘤(NHL)、慢性淋巴细胞白血病(CLL)和类风湿性关节炎(RA)等,其显著的疗效和良好的安全性已得到普遍认可。
据罗氏公司的财报显示,利妥昔单抗2017年全球销售业绩达到78.33亿瑞士法郎。其中,美国市场收入约为41.33亿瑞士法郎,占比为55.94%。
然而,由于负担不起进口药的费用,很多中国患者没有得到很好的医治。据2018年数据统计,美国的成人淋巴瘤5年生存率高达68.1%,而中国仅为38.3%。作为国家重大新药创制专项成果,此次达伯华®的上市,将有效降低相关患者的用药成本,提升临床用药可及性,为更多中国患者提供高品质且可负担的利妥昔单抗注射液,更好地满足百姓对高质量生物药的需求。如患者需要,请咨询康必行海外医疗医学顾问:4006-130-650.
更多药品详情请访问 利妥昔单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问