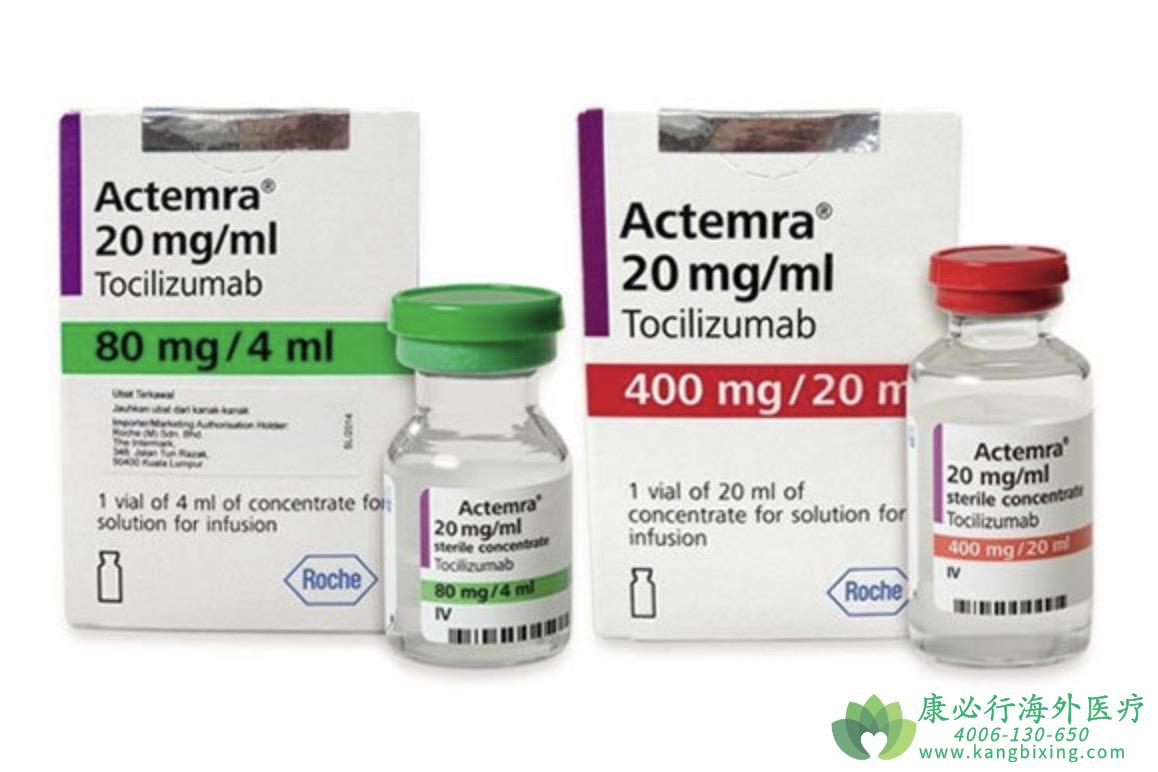
美国食品药品管理局(FDA)发布了Actemra(tocilizumab)的紧急使用授权(EUA),用于治疗正在接受系统性糖皮质激素治疗、需要补充氧气、无创或有创机械通气,或体外膜氧合(ECMO)的住院成人和儿童患者(2岁及以上),Actemra不被授权用于COVID-19门诊患者。
近日,美国食品药品管理局(FDA)发布了Actemra(tocilizumab)的紧急使用授权(EUA),用于治疗正在接受系统性糖皮质激素治疗、需要补充氧气、无创或有创机械通气,或体外膜氧合(ECMO)的住院成人和儿童患者(2岁及以上),Actemra不被授权用于COVID-19门诊患者。
在COVID-19住院患者的临床试验中,Actemra在常规护理患者接受COVID-19治疗(包括糖皮质激素治疗)的基础上,通过28天的随访降低了死亡风险,并减少了患者的住院时间。在28天的随访中,患者使用呼吸机或死亡的风险也降低了。
FDA药物评估和研究中心主任patricia Cavazzoni医学博士说:“今天的行动表明FDA致力于在全球COVID-19大流行的每个阶段提供新疗法。”“尽管疫苗已经成功减少了需要住院治疗的COVID-19患者数量,但为那些已经住院的患者提供额外的治疗是抗击这场大流行的重要一步。”
Actemra是一种单克隆抗体,通过阻断白细胞介素-6受体来减少炎症。在感染COVID-19的情况下,免疫系统会变得异常活跃,这可能导致疾病恶化。Actemra并不直接针对SARS-COV-2。Actemra是FDA批准的用于多种炎症性疾病(包括类风湿性关节炎)的静脉注射处方药物。根据今天的EUA,FDA正在批准Actemra紧急使用,用于治疗某些COVID-19住院患者。Actemra没有被批准作为COVID-19的治疗药物。
EUA的发布与FDA的批准不同,在决定是否发布EUA时,FDA会评估所有可用的科学证据,并仔细权衡紧急情况下使用的任何已知或潜在风险和任何已知或潜在益处。根据FDA对现有科学证据的整体审查,该机构已确定有理由相信Actemra可能对授权人群有效治疗COVID-19。而且,当用于治疗授权人群的COVID-19时,Actemra已知的和潜在的益处超过了该药物已知的和潜在的风险。Actemra目前还没有足够的、批准的和可用的替代疗法来治疗COVID-19,用于接受全身糖皮质激素治疗、需要补充氧气、无创或有创机械通气或ECMO的住院成人和儿科患者(2岁或以上)。
支持Actemra EUA的数据是基于四个临床试验。其中包括一项随机、对照、开放标签的平台试验[COVID-19治疗(RECOVERY)的随机评价]和三项随机、双盲、安慰剂对照试验(EMPACTA、COVACTA和REMDACTA)。尽管所有四项临床试验都有助于FDA对Actemra用于COVID-19治疗的理解,但关于Actemra授权使用的潜在益处的最重要科学证据来自RECOVERY和EMPACTA试验。
在RECOVERY试验中,4116名重症COVID-19肺炎住院患者被随机分为两组,一组接受Actemra加常规护理(2,022名患者),另一组接受常规护理(2,094名患者)。主要终点通过28天的随访评估死亡,主要分析的结果具有统计学意义。接受Actemra治疗的患者到第28天死亡的概率估计为30.7%,接受常规治疗的患者到第28天死亡的概率估计为34.9%。接受Actemra治疗的患者的平均出院时间为19天,接受常规治疗的患者的平均出院时间超过28天。
在EMPACTA试验中,389例COVID-19肺炎住院患者被随机分为Actemra(249例)和安慰剂(128例)。主要终点通过28天的随访评估是否需要机械通气或是否死亡。对于接受Actemra的患者,与接受安慰剂的患者相比,观察到机械通气进展或死亡的减少,初步分析结果具有统计学意义。接受Actemra的患者中需要机械通气或在第28天死亡的患者比例估计为12.0%,接受安慰剂的患者为19.3%。
在COVACTA试验中,452例COVID-19重症肺炎住院患者随机接受Actemra(294例)或安慰剂(144例)。主要终点是临床状态通过28天的随访评估7类顺序量表。尽管两组治疗组在第28天的7类顺序量表上的临床状态无统计学差异,但COVACTA试验有助于评估Actemra用于COVID-19治疗时的安全性。
在REMDACTA试验中,649例COVID-19重症肺炎住院患者随机接受Actemra联合瑞德西韦(430例)或安慰剂联合瑞德西韦(210例)。主要终点是出院时间或28天的随访“准备出院”。此外,尽管经过28天的随访,在出院时间或“准备出院”方面,治疗组之间没有观察到有统计学意义的差异,但REMDACTA试验有助于评估Actemra用于COVID-19治疗时的安全性。
根据EUA,必须向医疗保健提供者、患者、父母和护理人员提供关于授权使用Actemra治疗COVID-19的重要信息的情况说明。这些情况说明包括剂量说明、潜在副作用和药物相互作用。COVID-19临床试验中观察到的Actemra常见副作用包括便秘、焦虑、腹泻、失眠、高血压和恶心。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 Actemra https://www.kangbixing.com/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问