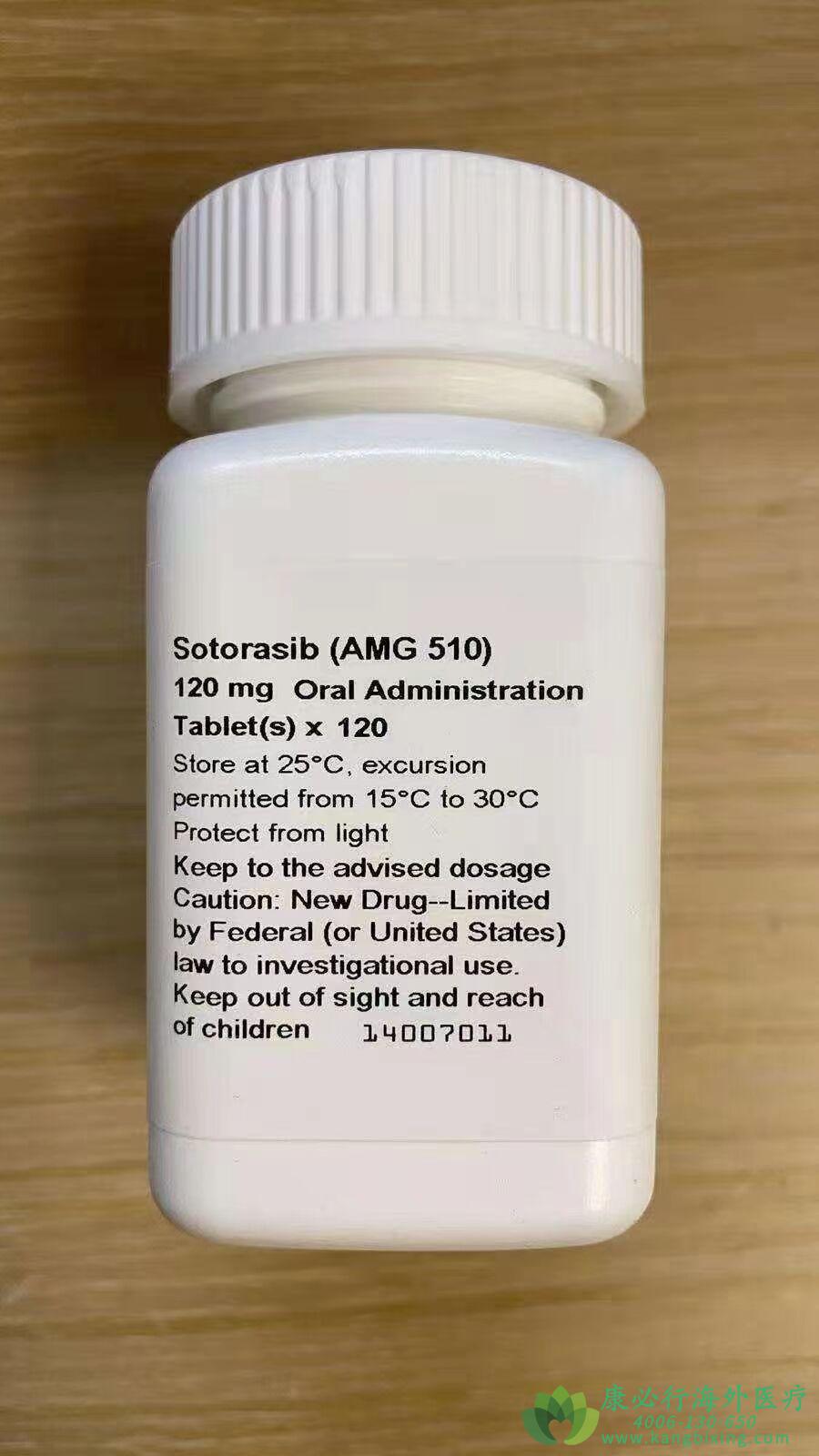
2022年1月20日,安进公司宣布日本已批准索托拉西布(Sotorasib)用于治疗KRAS G12C突变阳性,无法切除,晚期和/或复发的非小细胞肺癌(NSCLC),已取得进展的系统性抗癌治疗。
在此之前,美国FDA于去年中旬宣布加速批准索托拉西布(Sotorasib)上市,用于治疗肿瘤携带KRAS G12C突变的非小细胞肺癌(NSCLC)患者。这些患者至少接受过一种前期全身性治疗。这是全球首款靶向特定KRAS基因突变的抗癌疗法。
日本卫生、劳动和福利省MHLW是基于NSCLC第2期CodeBreaK 100临床试验的阳性结果,这是迄今为止针对非小细胞肺癌患者进行的最大规模的临床试验。来自124例接受免疫疗法和/或化疗后病情进展的KRAS G12C突变阳性NSCLC患者队列的数据显示,索托拉西布具有良好的疗效和耐受性。
该队列中,每日口服一次960mg 索托拉西布治疗的客观缓解率(ORR,肿瘤体积缩小≥30%的患者比例)为36%(95%CI:28-45)、81%(95%CI:73-87)的患者实现疾病控制(达到完全缓解、部分缓解和病情稳定超过3个月的患者比例)。中位缓解持续时间(DoR)为10个月。最常见的不良反应(≥20%)为腹泻、肌肉骨骼疼痛、恶心、乏力、肝毒性和咳嗽。9%的患者出现了导致永久停药的不良反应。
此前公布的探索性分析还显示,在一系列生物标志物亚组中均观察到索托拉西布令人鼓舞的肿瘤反应,包括PD-L1表达水平阴性或水平低的患者和STK11突变的患者。这种共突变与接受检查点抑制剂和化疗的NSCLC患者的不良预后相关。最常见的不良反应(发生率为≥5%)为腹泻(28%)、恶心、丙氨酸转氨酶(ALT)升高、天冬氨酸转氨酶(AST)升高(16%)、疲劳(11%)、血碱性磷酸酶(8%)、呕吐(7%)和腹痛(5%)。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 索托拉西布 https://www.kangbixing.com/drug/stlxb/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问