关于本次常规批准,主要依据是1期GARNET试验(NCT02715284)数据的支持:多塔利单抗在dMMR子宫内膜癌患者队列中(n=95)表现良好,37.0%的患者肿瘤完全消失,54.0%的患者肿瘤大幅缩小。
此外,该药物的有效持续时间仍未到顶峰,仍在延长。值得注意的是,大多数(85.9%)患者的肿瘤缓解已经达到1年或更长时间,超过一半(54.7%)的患者肿瘤缓解持续时间已经达2年或更长时间。
这项多中心、多队列、开放标签试验招募了多种晚期实体瘤患者。其中,子宫内膜的队列是由含铂方案之前或之后进展的dMMR复发或晚期疾病患者组成。
以前接受过PD-1/PD-L1药物或其他免疫检查点抑制剂的患者不可入组,那些在入组后2年内需要使用免疫抑制剂进行全身治疗的自身免疫性疾病患者也被排除在外。
研究参与者接受多塔利单抗静脉注射治疗,直到疾病进展或不可耐受毒性。
值得注意的是,所有参与者以前都接受过抗癌治疗。具体而言,89%的患者既往接受过手术,71%的患者接受过放疗。超过一半的患者(63%)接受过1线治疗,37%的患者接受过2线或更多线的既往治疗。
在150名参加试验的dMMR晚期或复发性子宫内膜癌患者中,检测了该药的安全性。
在20%或更多患者中观察到的常见的毒性包括虚弱,贫血,皮疹,恶心,腹泻,便秘和呕吐。
只有1例接受多塔利单抗治疗的患者出现致命的不良反应,具体来看,是因为并发了免疫介导的脑炎和尿路感染问题。
28%的患者因为转氨酶增加、脓毒症、支气管炎、肺炎、皮疹、瘙痒、胰腺炎、脑炎和肾炎等毒性,需要永久停止接受多斯塔利单抗治疗,具体症状包括贫血、腹泻、虚弱、结肠炎、败血症和肺炎。
多塔利单抗实际上也是一种PD-1免疫检查点抑制剂,就像我国已上市的帕博利珠单抗、纳武单抗等。目前,多塔利单抗在dMMR的实体瘤中表现不错,而具有这类特征的患者,多见于子宫内膜癌和结直肠癌,但在其他各类癌症的发生率相对较低。
对试验中150例dMMR晚期或复发性子宫内膜癌患者进行了安全性检查。41%的患者药物暴露超过1年,23%的患者超过2年。在患者中观察到的最常见毒性(≥20%)包括乏力、贫血、皮疹、恶心、腹泻、便秘和呕吐。患者中最常出现的3级或4级不良反应(2%)是淋巴细胞减少、钠减少、ALT增加、肌酐增加、中性粒细胞减少、白蛋白减少和ALP增加。38%的患者使用多塔利单抗出现严重毒性,在少数患者(≥2%)中观察到尿路感染(4%)、败血症(3.3%)、急性肾损伤(2.7%)和腹痛(2.7%)。只有1名接受多塔利单抗的患者出现了致命的不良反应——因为并发免疫介导的脑炎和尿路感染。10%的患者因转氨酶升高、败血症、支气管炎、肺炎、皮疹、瘙痒、胰腺炎、脑炎和肾炎等毒性而需要永久停止服用多塔利单抗。不良反应导致28%的患者治疗中断,这些不良反应包括贫血、腹泻、乏力、结肠炎、败血症和肺炎。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
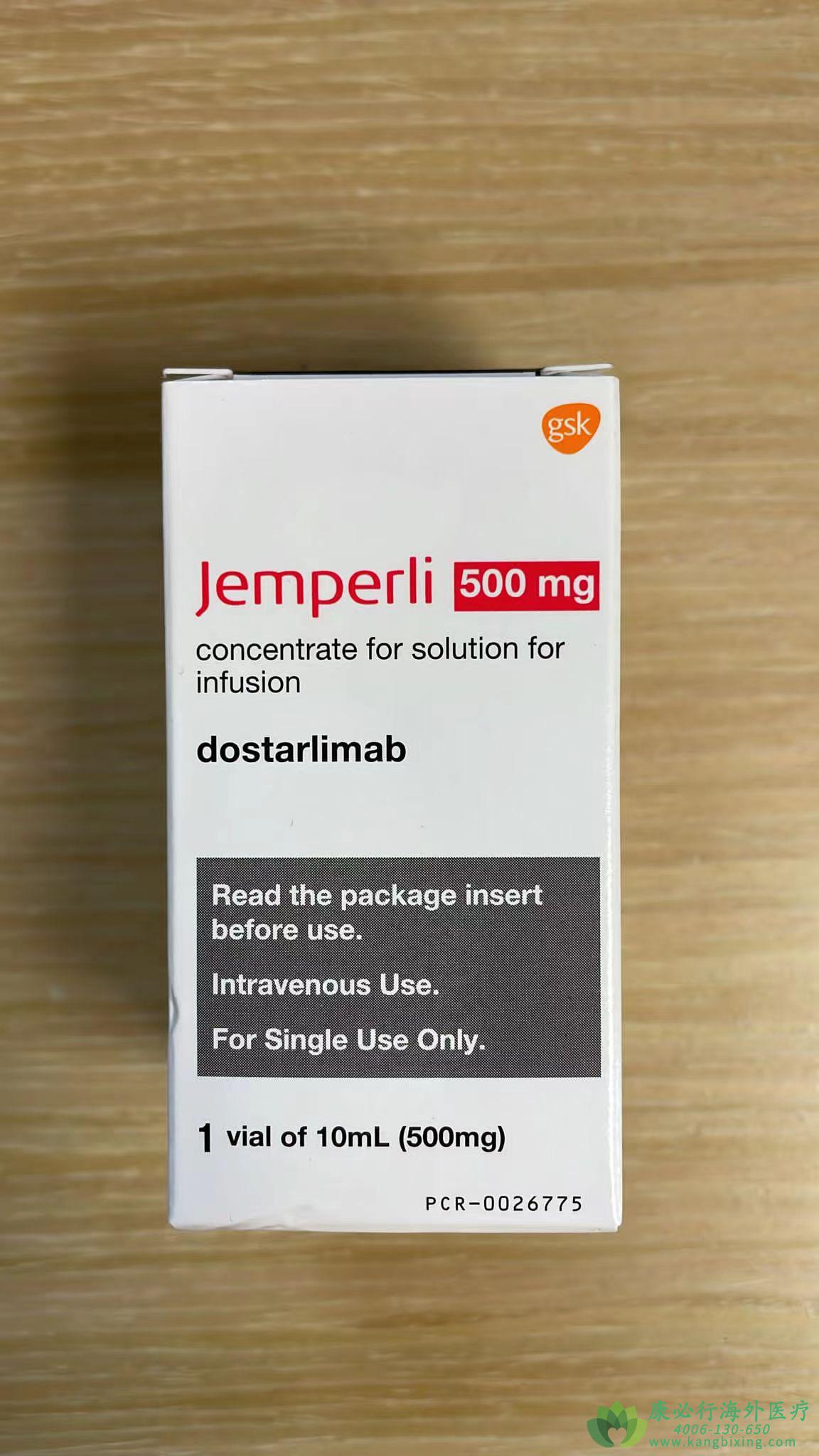
更多药品详情请访问 多塔利单抗 https://www.kangbixing.com/drug/dostarlimab/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问