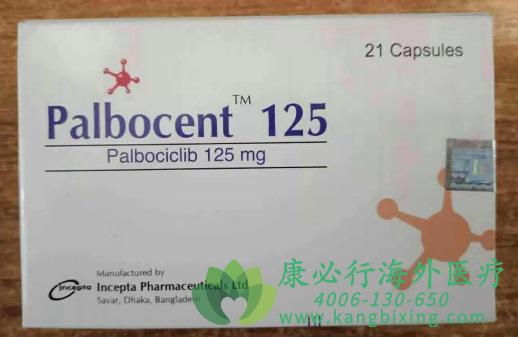
帕博西尼(也译为哌柏西利,Palbociclib),商品名爱搏新(IBRANCE),是由美国辉瑞公司(Pfizer Inc.)研发的全球首个细胞周期蛋白依赖性激酶(Cyclin Dependent Kinase,CDK)4/6抑制剂。2015年2月3日,美国食品药品管理局(Food and Drug Administration,FDA)加速批准帕博西尼上市,用于治疗ER+/HER2-绝经后晚期乳腺癌。Palbociclib(帕博西尼)较来曲唑可使乳腺癌无进展生存期延长一倍,是乳腺癌患者的新希望,疗效获得突破。
2015年2月3日,帕博西尼(Palbociclib)首次获得FDA加速批准,联合来曲唑作为治疗ER+、HER2-绝经后晚期乳腺癌患者的初始方案。获得FDA加速批准的原因是基于一项II期临床试验PALOMA-1研究(该研究入组165名未经治疗的晚期绝经后HR+的患者,84例患者接受帕博西尼+Letrozole治疗,81例患者接受placebo+Letrozole治疗)最终结果-使用帕博西尼的乳腺癌患者的PFS与对照组对比为20.2 VS 10.2个月,PFS几乎翻倍。
2016年2月,FDA常规批准帕博西尼+fulvestrant联合治疗,作为初始内分泌治疗后疾病恶化的HR+、HER2-晚期或转移性乳腺癌患者的治疗方案。该批准主要是基于Ⅲ期试验PALOMA-3的研究结果。该研究主要终点为PFS,次要终点为OS。当时研究结果显示帕博西尼+fulvestrant治疗组患者的中位无进展生存期(PFS)为9.5个月VS placebo+fulvestrant治疗组患者的PFS为4.6个月,PFS与绝经情况无关,且各预指定因子亚组获益一致;将帕博西尼加入标准氟维司群方案治疗经治的HR+、HER2-患者能获得超过两倍的无进展生存改善,将疾病进展时间推迟了将近5个月。
2018年7月31日,帕博西尼(Palbociclib)成功登陆国内,获NMPA加速批准上市。获批上市是基于III期PALOMA-2临床试验,研究结果为帕博西尼+Letrozole疗法组的患者相比于placebo+Letrozole疗法组的患者,在MST(25.7个月VS 13.9个月)上,延长了近一倍,在PFS上延长近11个月(24.8个月vs 14.5个月);而且还能减少患者的副作用,提高患者的生活质量。帕博西尼在国内的上市为中国晚期乳腺癌患者提供了新的治疗选择。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 帕博西尼 https://www.kangbixing.com/bxyw/pbxn/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问