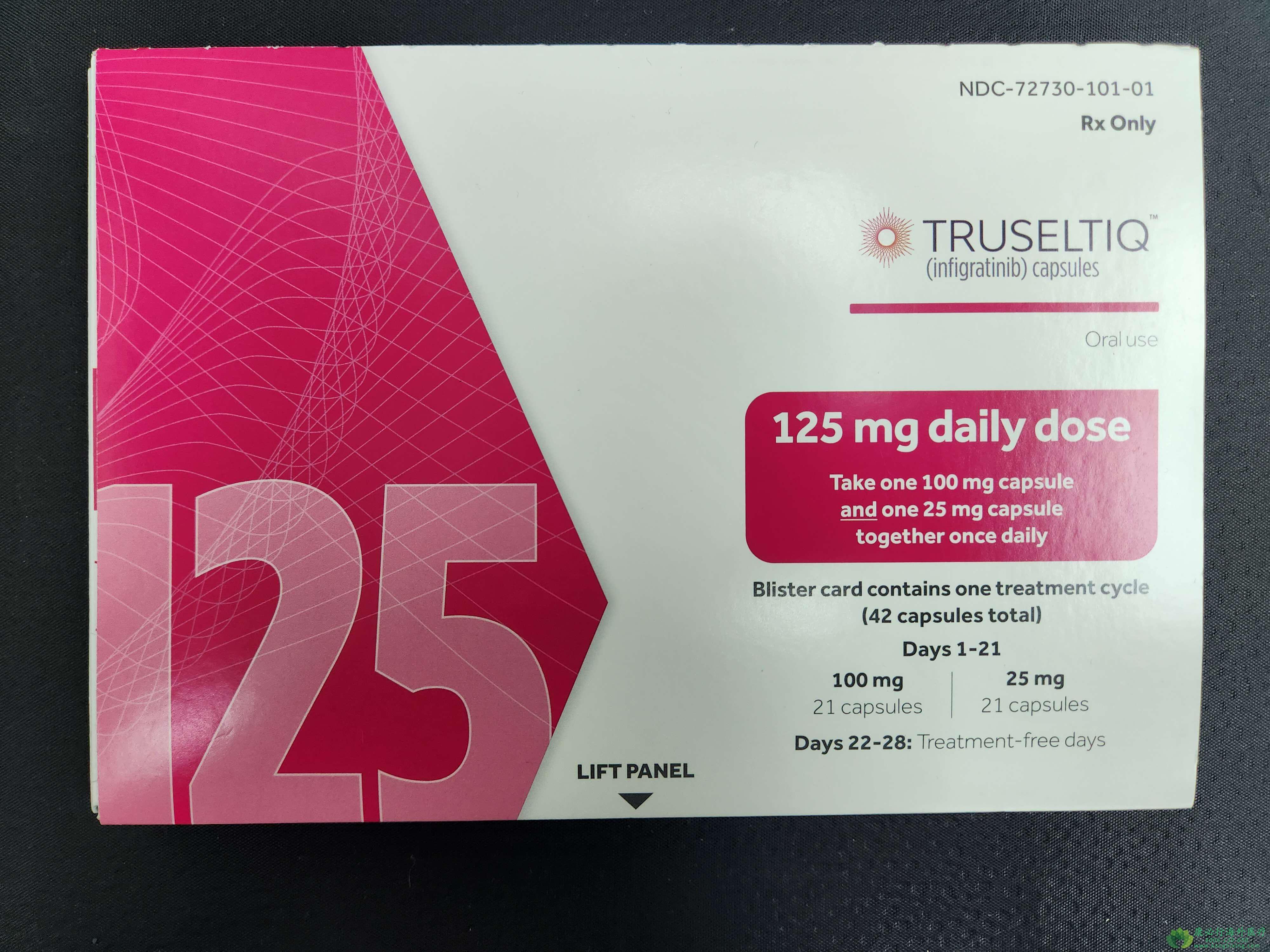
英菲格拉替尼是一种强效口服、选择性、ATP竞争性的FGFR激酶抑制剂,对FGFR 1、2和3的亲和力最高。此前,2021年5月29日,美FDA已加速批准英菲格拉替尼用于治疗先前接受过治疗、携带FGFR2融合或重排的局部晚期或转移性胆管癌(CCA)患者。2023年3月28日,国家药监局药品审评中心(CDE)官网公示,联拓生物引进的口服FGFR1-3选择性抑制剂英菲格拉替尼(中文通用名:英菲格拉替尼)拟纳入突破性治疗品种,拟定适应症为:既往接受过至少两线系统性治疗的、伴有FGFR2基因扩增的局部进展期或转移性胃癌或胃食管结合部腺癌患者。
2021年8月25日,联拓生物与生物技术公司BridgeBio Pharma宣布,在英菲格拉替尼治疗局部晚期或转移性胃癌或伴有成纤维细胞生长因子受体-2(FGFR2)基因扩增的胃食管交界处腺癌和其他伴有FGFR基因组改变的晚期实体瘤的IIa期临床试验中,已完成首例患者治疗。
该项IIa期试验是一项在中国进行的多中心、开放标签、单臂研究,旨在评估英菲格拉替尼在伴有FGFR2基因扩增的局部晚期或转移性胃癌或胃食管结合部腺癌患者,以及因FGFR基因变异导致的其他晚期实体瘤患者中的安全性和有效性。试验的主要终点是客观缓解率(ORR);次要终点包括缓解持续时间(DOR)、疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)以及安全性。
临床前数据表明,英菲格拉替尼可能对胃癌患者有潜在的疗效。发表在Cancer Discovery杂志上的结果表明,在多个FGFR2扩增的胃癌模型中观察到肿瘤消退。
联拓生物表示,预计将在2023年下半年公布英菲格拉替尼治疗伴有FGFR2基因扩增的局部晚期或转移性胃癌或胃食管结合部腺癌以及伴有FGFR基因改变的其他晚期实体瘤的IIa期临床试验的顶线数据结果;预计将在2024年上半年启动英菲格拉替尼治疗伴有FGFR2基因扩增的局部晚期或转移性胃癌患者的关键性II期试验,以支持其在中国的上市审批。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 英菲格拉替尼 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问












