玛格妥昔单抗(Margenza,MGAH22)与化学疗法的组合,用于治疗已接受两种或更多种先前抗HER2方案的成年转移性HER2阳性乳腺癌患者(三线治疗)。FDA批准了单克隆抗体玛格妥昔单抗(Margenza,MGAH22)与化学疗法的组合,用于治疗已接受两种或更多种先前抗HER2方案的成年转移性HER2阳性乳腺癌患者(三线治疗)。该组合的批准是基于margetuximab联合化学疗法与曲妥珠单抗(Herceptin)联合化疗作为治疗已接受过抗HER2治疗的HER2阳性转移性乳腺癌患者的SOPHIA 3期临床试验的数据。
在这项随机研究中,266例患者接受了margetuximab(每3周静脉注射15 mg/kg)联合化疗,而270例接受了曲妥珠单抗联合化疗。该研究的目的是证明实验性margetuximab组合的疗效,该组合可能为曲妥珠单抗,帕妥珠单抗(Perjeta)或TDM-1(Kadcyla)治疗后复发或难治的患者提供新的选择。为了证明疗效,该研究探索了无进展生存期(PFS),总生存期(OS)和安全性的主要终点。次要终点包括研究者评估的PFS,通过独立的放射学检查得出的客观缓解率(ORR),以及由任何等级的输注相关反应的发生率定义的安全性。
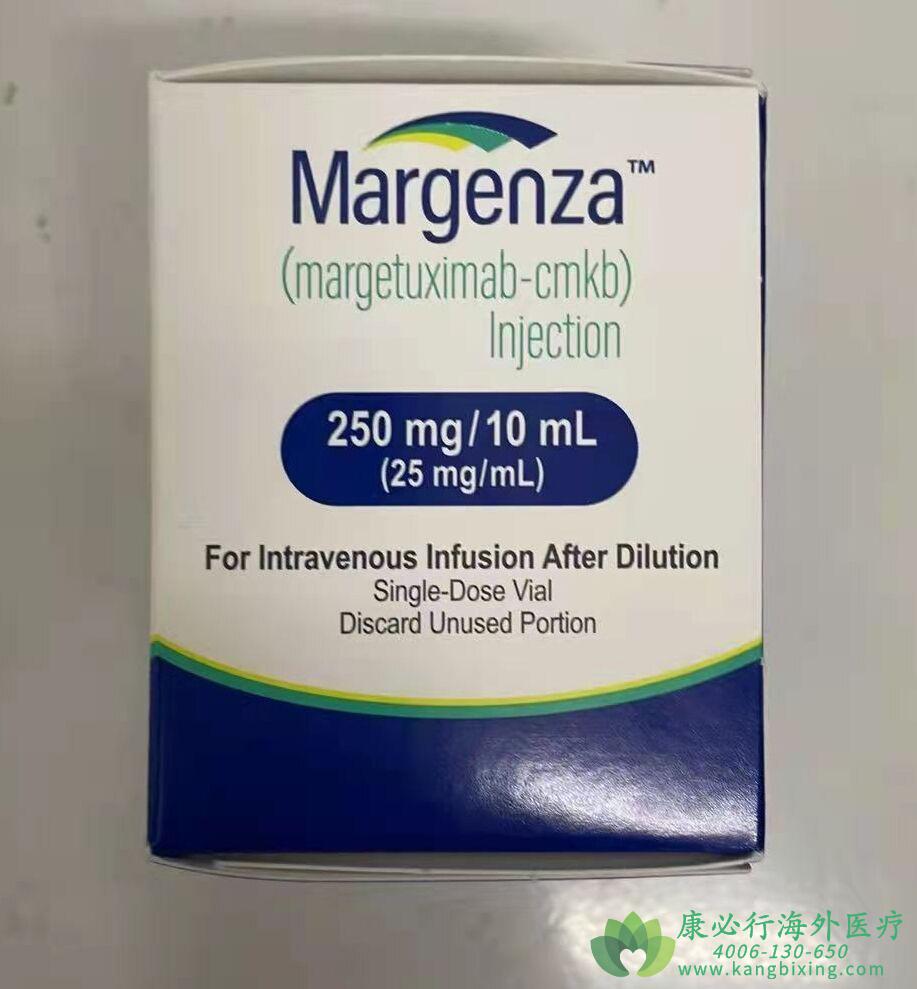
用法用量:仅用于静脉输液。
初始剂量在120分钟内以15mg/kg的静脉输注方式服用MARGENZA,然后在接下来的所有剂量中每3周至少间隔30分钟。
在同时使用MARGENZA和化疗的日子里,可以在化疗完成后立即使用MARGENZA。
剂量形式和强度
注射:单剂量小瓶中250mg/10mL(25mg/mL)
作用机制:玛格妥昔单抗是Fc工程改造的HER2定向单克隆抗体。玛格妥昔单抗-cmkb与人表皮生长受体蛋白(HER2)的胞外域结合。与表达HER2的肿瘤细胞结合后,margetuximab-cmkb抑制肿瘤细胞增殖,减少HER2细胞外结构域的脱落并介导抗体依赖性细胞毒性(ADCC)。
常见不良反应:MARGENZA与化学疗法联合使用最常见的药物不良反应(>10%)是疲劳/乏力,恶心,腹泻,呕吐,便秘,头痛,发热,脱发,腹痛,周围神经病,关节痛/肌痛,咳嗽,食欲下降,呼吸困难,与输注相关的反应,掌-红斑感觉异常和四肢疼痛。
Margenza的活性药物成分margetuximab是一种Fc结构域优化的免疫增强单克隆抗体,靶向阻断HER2蛋白。margetuximab具有与曲妥珠单抗相似的HER2结合和抗增殖作用,同时其工程化的Fc结构域能够增加免疫系统的参与。在体外试验中,玛格妥昔单抗经修饰的Fc结构域增强了与激活性Fc受体FCGR3A(CD16A)的结合,并减少了与抑制Fc受体FCGR2B(CD32B)的结合。这些变化导致了更大程度的体外ADCC和NK细胞活化。
2018年11月,再鼎医药与MacroGenics达成合作,获得margetuximab在大中华区的开发及商业化权利。2020年12月,美国FDA批准Margenza联合化疗,用于治疗转移性HER2阳性乳腺癌成人患者,具体为:先前已接受过2种或多种抗HER2方案治疗、其中至少一种用于治疗转移性疾病的患者。这一完全批准基于SOPHIA研究的无进展生存期(PFS)结果。根据该结果,Margenza是第一个在头对头3期临床试验中与曲妥珠单抗相比显著改善PFS的HER2靶向疗法。
虽然SOPHIA研究ITT人群的OS结果令人失望,但在CD16A 158F纯合子患者亚组(“F/F”患者,约占所有HER2阳性乳腺癌患者的40%,在SOPHIA研究中占整个研究人群的35.8%)中观察到了更高的OS获益,这与在Margenza的工程Fc区域观察到的增强一致。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 玛格妥昔单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问












