CCA又称胆管癌,是一种由胆管细胞DNA突变引起的严重且常致命的疾病。根据其解剖位置,CCA分为肝内胆管癌,肝门周围胆管癌和远端胆管癌三种类型。据估计,患有这种疾病的患者中有15%至20%患有FGFR2基因异常。晚期不可切除的CCA是一种罕见的侵袭性恶性肿瘤,预后差。CCA的体征和症状包括皮肤和眼白发黄(黄疸)、皮肤强烈瘙痒、白色粪便、疲劳、腹痛和意外体重减轻。CCA的中位五年生存率仅为9%。美国和欧盟(EU)每年约有2万人被诊断为CCA。
英菲格拉替尼(inffigratinib)是一种口服激酶抑制剂,用于治疗既往治疗过的、不可切除的局部晚期或转移性胆管癌(CCA),并伴有成纤维细胞生长因子受体II(FGFR2)融合的成人患者。Infigratinib是由美国生物制药公司BridgeBio Pharma的子公司QED Therapeutics开发的。
英菲格拉替尼是一种FGFR小分子ATP竞争性酪氨酸激酶抑制剂。肿瘤中FGFR的改变可导致组成型FGFR信号,支持恶性细胞的增殖和存活。
英菲格拉替尼通过选择性结合和抑制FGFR活动阻断下游信号级联。它通过减少癌细胞增殖诱导肿瘤细胞死亡。
FDA批准的infigratinib英菲格拉替尼是基于多中心,开放标签,单臂II期临床试验的结果。该研究招募了108名先前接受过治疗,无法切除的局部晚期或转移性CCA并伴有FGFR2融合或重排的患者,以评估英菲格拉替尼的疗效。
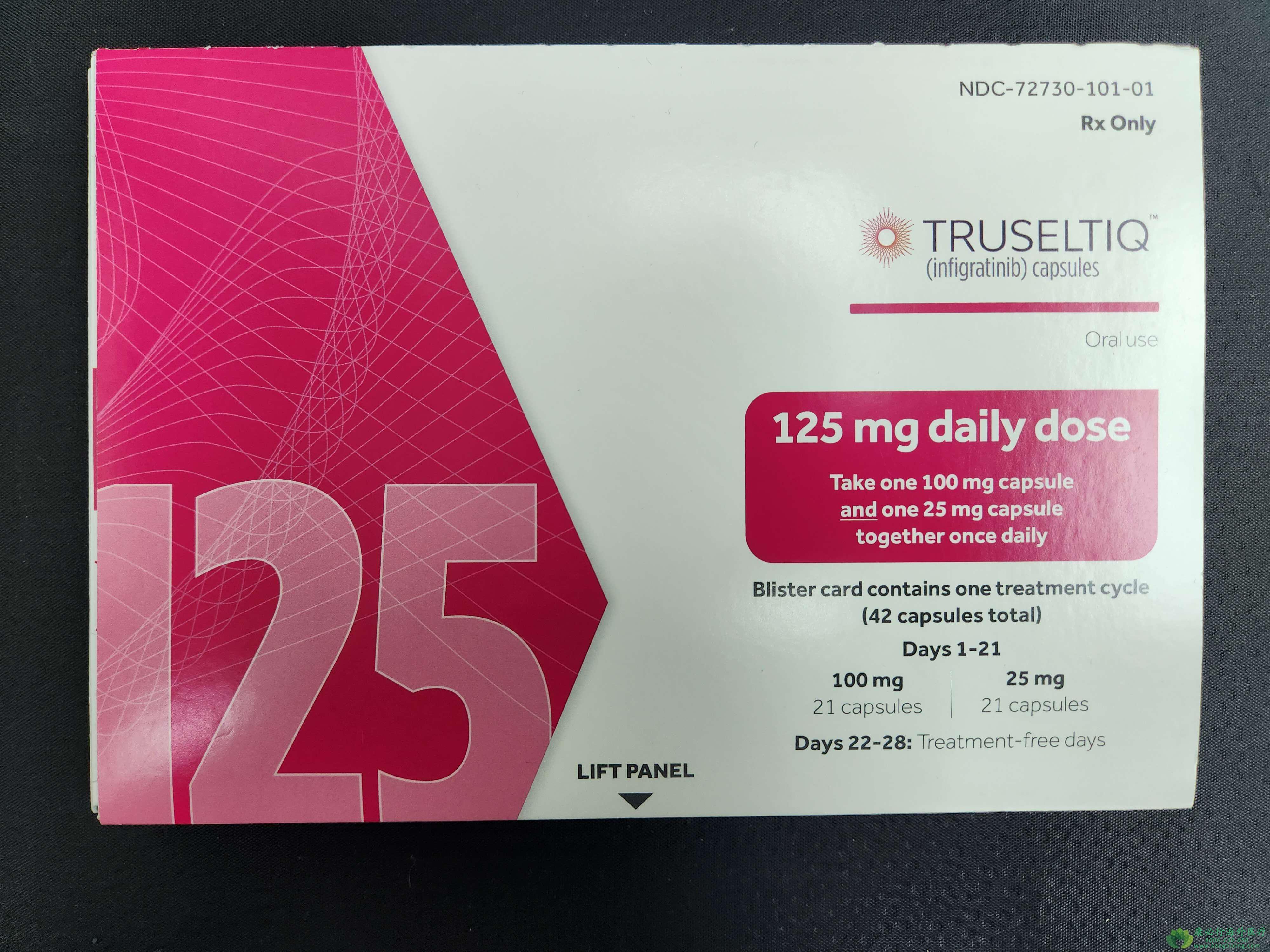
该研究的主要疗效结果指标是总体反应率(ORR)和反应持续时间(DOR),由盲法独立中央评估(BICR)根据实体瘤反应评估标准(RECIST)规范1.1版确定。在这项研究中,患者每天接受一次125mg的英菲格拉替尼治疗21天,然后在一个28天的治疗周期中间隔7天治疗,直到疾病进展或不可接受的毒性。
英菲格拉替尼达到23%ORR,包括1%完全缓解和22%部分缓解。患者的中位DOR为5个月。临床研究期间患者常见的不良事件报告肌酐和磷酸盐升高,磷酸盐降低,指甲中毒,口腔炎,碱性磷酸酶升高和血红蛋白下降。
接受英菲格拉替尼治疗的患者还出现了丙氨酸转氨酶升高、干眼症、疲劳、脂肪酶增加、淋巴细胞减少、钙增加、钠减少、脱发、甘油三酯和天冬氨酸转氨酶增加、血小板减少、尿酸盐增加、掌跖感觉异常综合征、关节痛和发音困难。严重的危险包括高磷血症和视网膜色素上皮脱离。
美国FDA接受了QED therapy的新药申请(NDA),该申请被指定为优先审查药物。在FDA的实时肿瘤学审查(RTOR)试点计划下,对NDA进行了审查。2021年5月,FDA加速批准英菲格拉替尼用于治疗带有FGFR2融合或其他重排的胆管癌成年患者。FDA还批准了Foundation Medicine的FoundationOne CDx综合基因组分析(CGP)测试作为注册伴随诊断,以帮助选择可能受益于接受英菲格拉替尼治疗的FGFR2融合或其他重排患者。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 英菲格拉替尼 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问












