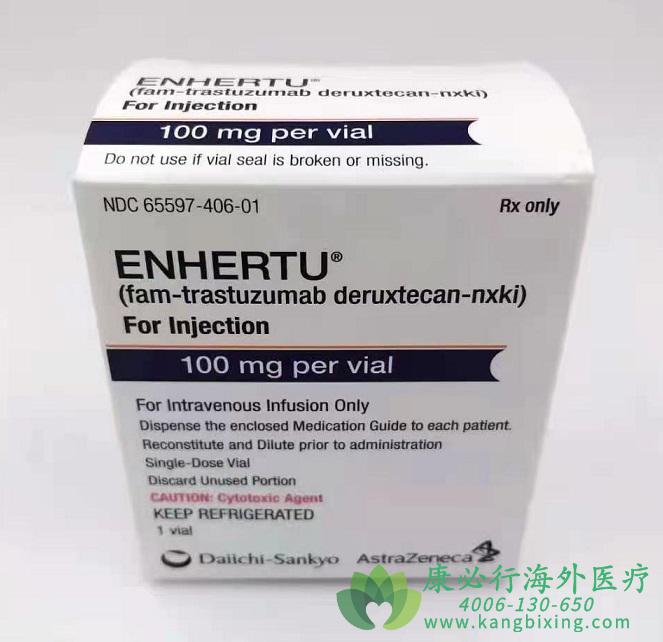
此次德喜曲妥珠单抗在中国获批上市,表面我国乳腺癌领域将迎来新突破。基于DESTINY-Breast04研究结果,优赫得(5.4 mg/kg)已在美国、巴西、加拿大、欧盟和澳大利亚获批用于治疗既往在转移阶段接受过化疗,或在辅助化疗期间或完成辅助化疗之后6个月内出现疾病复发的不可切除或转移性HER2低表达(免疫组化[IHC]1+或IHC 2+/原位杂交[ISH]-)成人乳腺癌成人患者。2022年8月,第一三共已向中国国家药品监督管理局药品审评中心提交了针对HER2低表达适应症的上市申请。
DESTINY-PanTumor02由268名患者参与,试验共有7个队列,对Enhertu进行了胆道、膀胱、宫颈、子宫内膜、卵巢、胰腺和罕见癌症的评价。此项II期临床试验显示,在重度预处理的患者中,Enhertu在多个表达HER2的晚期实体瘤中显示出持久的反应,达到了预先设定的目标客观反应率(ORR)。
目前德喜曲妥珠单抗在全球获批了HER2阳性乳腺癌、胃癌、胃食管交界处癌、HER2低表达乳腺癌、非小细胞肺癌5项适应症。
目前,德喜曲妥珠单抗已成为NCCN指南中最新二线优选方案。在最新版CSCO乳腺癌临床指南中,HER2阳性晚期乳腺癌II级推荐中也新增了德喜曲妥珠单抗的使用,主要源于治疗HER2阳性乳腺癌三期临床试验中,德喜曲妥珠单抗头对头完胜T-DM1:中位无进展生存期(mPFS)延长近两年;客观缓解率(ORR)达78%;超过五分之一(21.1%)的患者达到疾病完全缓解(CR),即肿瘤病灶完全消失。此次获批之前,T-DM1是全球首个且目前唯一获批用于HER2阳性早期和晚期乳腺癌的ADC药物。
德喜曲妥珠单抗全球获批时间及适应症
2019.12
FDA批准第一三共的德喜曲妥珠单抗(Enhertu,fam-trastuzumab deruxtecan-nxki)用于治疗HER2阳性不可切除或转移性乳腺癌成人患者,这些患者在出现转移的情况下已接受过两种或两种以上抗HER2疗法。
2021.1
FDA批准德喜曲妥珠单抗(Enhertu)用于既往接受过曲妥珠单抗治疗的局部晚期或转移性HER2阳性胃或胃食管交界(GEJ)腺癌患者,这是首个被批准治疗HER2阳性胃癌的抗体偶联(ADC)药物。
2022.5
FDA批准德喜曲妥珠单抗用于既往接受过至少一种以上抗HER-2治疗的不可切除或转移性HER-2阳性乳腺癌成人患者的二线治疗。
2022.8.5
FDA批准了德喜曲妥珠单抗通过静脉输液的方式治疗无法切除或转移性HER2低表达乳腺癌患者。这是首个获批针对HER2低表达乳腺癌亚型患者的疗法,该亚型是新定义的HER2阴性乳腺癌亚型。
2022.8.11
FDA加速批准德喜曲妥珠单抗用于治疗不可切除或转移性非小细胞肺癌(NSCLC)成人患者,这些患者经FDA批准的测试检测到携带HER2突变,并且之前接受过全身治疗。值得一提的是,该批准创下了又一个“第一”,这是FDA批准的第一款针对HER2突变阳性非小细胞肺癌患者的药物。
2023.2.24
NMPA(中国国家药品监管局)宣布,由阿斯利康和第一三共联合开发和商业化的ADC药物德喜曲妥珠单抗(英文商品名Enhertu、中文商品名优赫得)已获得上市许可,获批适应症为既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。
目前,乳腺癌是全球范围内最常见的癌症,也是癌症相关死亡的主要原因之一。根据GLOBOCAN 2020全球癌症报告,2020年全球确诊乳腺癌病例超过226万,导致约68.4万人死亡。同样,乳腺癌也是中国女性最常见的癌症,2020年新确诊乳腺癌约416371例,导致117174例死亡。中国晚期乳腺癌患者总体5年生存率不足50%,患者在经历传统治疗手段后5年内极易出现肿瘤复发和远端转移,复发转移患者3年生存率不足40%,总体生存期十分有限。
HER2是一种酪氨酸激酶受体促生长蛋白,在多种肿瘤表面表达,包括乳腺癌、胃癌、肺癌和结直肠癌等。HER2过表达由HER2突变、扩增或其它原因引起,通常与乳腺癌侵袭性强和不良预后相关,约五分之一的乳腺癌患者被确诊为HER2阳性。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 德喜曲妥珠单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问