美国食品药品监督管理局(FDA)加速埃万妥单抗批准强生公司研发生产的EGFR/c-Met双抗Rybrevant上市,用于治疗铂类化疗后进展的EGFR外显子20插入突变(EGFR20ins)的转移性非小细胞肺癌(NSCLC)患者。这是FDA批准的埃万妥单抗首个针对该类突变的药物。在2020年欧洲肿瘤内科学会(ESMO)年会上公布的联合方案的先前结果显示,该方案在中位随访4个月后有望实现。当时的客观缓解率(ORR)为36%,由1个确认的完全缓解和15个部分缓解组成,临床受益率(CBR)为60%。
最新结果显示,中位随访11.0个月(范围,1.0-15.0),ORR为36%(95%CI,22%-51%),CBR为64%(95%CI,49%-78%))。中位反应持续时间(DOR)为9.6个月(95%CI,5.3至未达到[NR]),69%的反应持续至少6个月。中位无进展生存期(PFS)为4.9个月(95%CI,3.7-9.5)。
安全性方面,16%的患者报告了治疗相关的≥3级AE,4%的患者停止治疗,18%的患者需要减少剂量。最常见的AE是输液相关反应(78%)、皮疹(痤疮样皮炎,51%;皮疹,27%)和甲沟炎(49%),其中大部分为1级或2级。
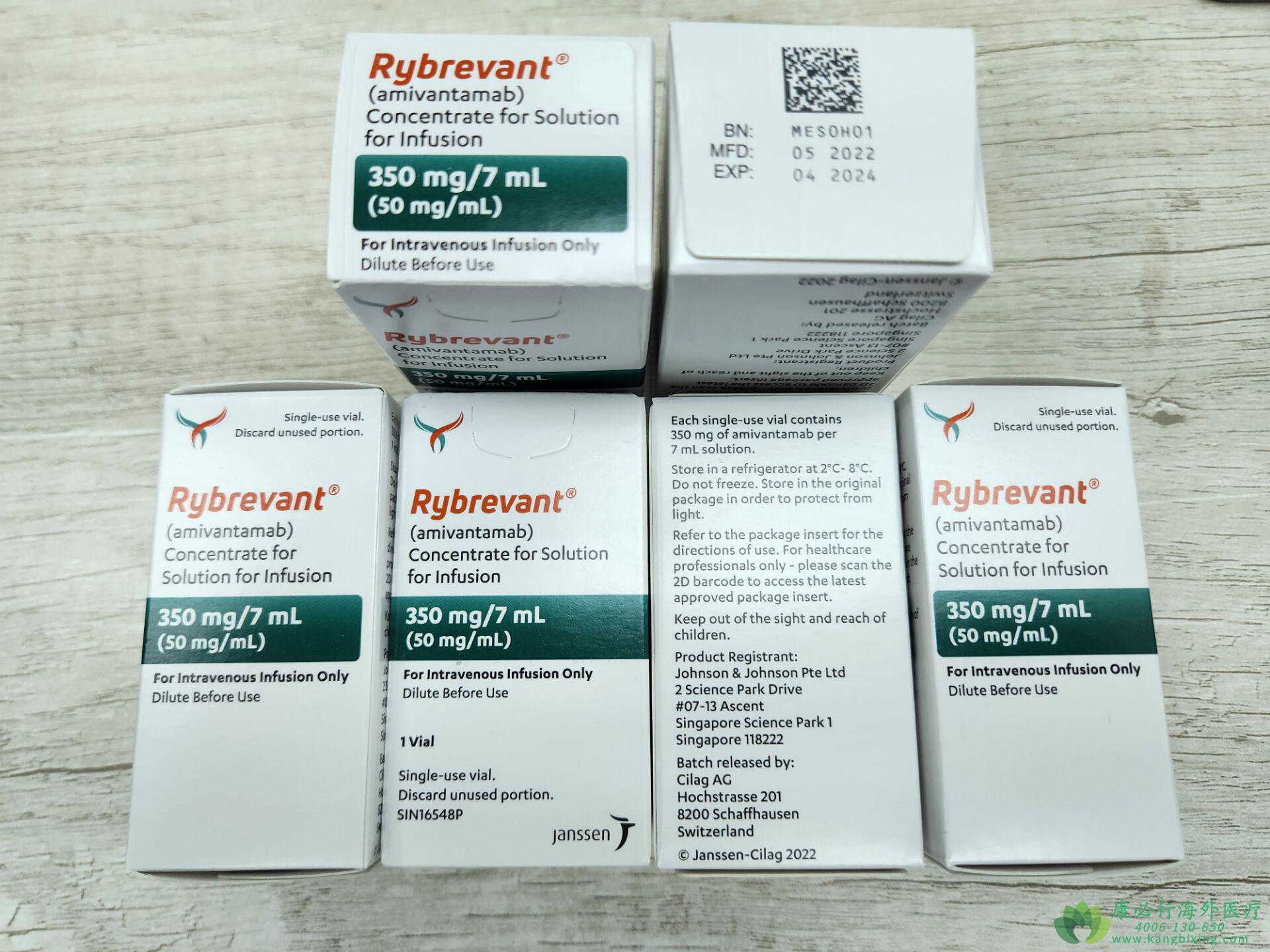
RYBREVANT埃万妥单抗的推荐剂量:基于基线体重,稀释后作为静脉输注给药。<80kg,1050 mg;≥80kg,1400 mg;按建议进行术前给药。在第1周和第2周通过外围线路给药。每周输注RYBREVANT,持续4周,初始剂量在第1周的第1天和第2天分次输注,然后每2周给药一次。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 埃万妥单抗 https://www.kangbixing.com/drug/awtdk/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问