此次新适应症批准,基于全球3期ClarIDHy试验的数据支持。这是第一个也是唯一一个针对先前治疗过的IDH1突变胆管癌患者开展的3期随机试验。入组的这些患者先前在接受过1种或2种系统疗法后出现疾病进展。研究中,患者以2:1的比例随机分配,接受依维替尼(500mg,每日一次)或安慰剂治疗。安慰剂组患者在记录到影像学进展时允许交叉使用依维替尼治疗。该试验的主要终点是:通过独立放射学评估确定的无进展生存率(PFS)。次要终点包括:研究者评估的PFS、安全性和耐受性、总缓解率(ORR)、总生存期(OS)、缓解持续时间(DOR)、药代动力学、药效学和生活质量评估。
截至2020年5月31日,共有187名患者被随机分组,其中126名患者在依维替尼组,61名患者在安慰剂组。43例随机接受安慰剂治疗的患者(70.5%)在影像学疾病进展和揭盲后交叉使用开放标签依维替尼治疗。
结果显示,依维替尼组的中位无进展生存期(PFS)为2.7个月,而安慰剂组为1.4个月(HR=0.37,95%CI:0.25-0.54,p<0.001),死亡风险降低了63%;依维替尼组的中位总生存期(OS)为10.8个月,安慰剂组为9.7个月(HR=0.69,95%CI:0.44-1.10,p=0.06);依维替尼组疾病控制率(DCR)为53%,安慰剂组为28%;依维替尼组的客观缓解率(ORR)为2%,安慰剂组为0%。依维替尼通过抑制肿瘤细胞增殖,阻止肿瘤进展,稳定胆管癌患者的情况,所以2%的数据看似低,但是依维替尼的疾病控制率却高达53%。
值得一提的是,临床方案规定,接受安慰剂治疗的患者在疾病进展时可以转向依维替尼治疗,事实上,在安慰剂组中有高比例的患者(70.5%)转向了依维替尼治疗。根据保秩结构失效时间(RPSFT)模型,预先指定的交叉调整分析结果显示,安慰剂组患者的中位OS为5.1个月(HR=0.49,95%CI 0.34–0.70,单侧p<0.0001)。研究中观察到的安全性与先前公布的数据一致。
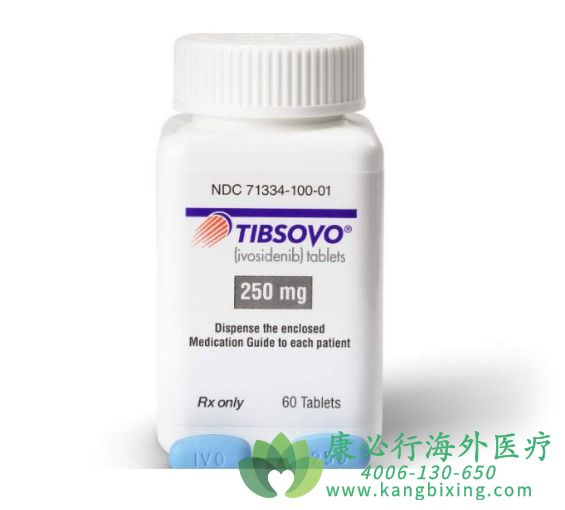
胆管癌是一种罕见的,侵袭性的癌症,其有效疗法有限,患者急需新的治疗选择,尤其是那些在化疗后经历疾病进展的患者。FDA收到了IDH1+胆管癌中依维替尼的新药申请,一项新的药物申请已向FDA提交了依维替尼片(Tibsovo)的治疗方案,作为先前治疗过IDH1突变的胆管癌患者的潜在治疗选择。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!



 添加康必行顾问,想问就问
添加康必行顾问,想问就问