剂型及优势

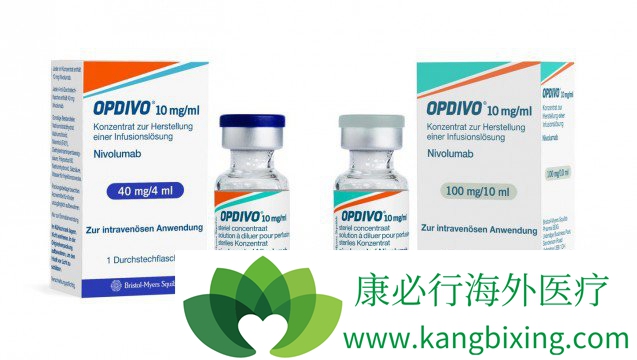
IV解决方案
-
40mg / 4mL(10mg / mL)
-
100mg / 10mL(10mg / mL)
-
给药前需要进一步稀释
黑色素瘤
单剂
-
表示为BRAF V600野生型或BRAF V600突变阳性不可切除或转移性黑色素瘤的单一药剂
-
240毫克IV q2wk注入超过1小时
-
继续直到疾病进展或不可接受的毒性
联合ipilimumab
-
表明与ipilimumab组合治疗BRAF不可切除或转移性黑色素瘤患者
-
1 mg / kg IV注射超过1小时,其次是ipilimumab(3 mg / kg IV注射超过90 min),同时服用q3wk 4次
-
作为单一药剂的随后剂量的nivolumab在1小时内注入240mg IV q2wk,直到疾病进展或不可接受的毒性
非小细胞肺癌

表明在铂类化疗后进行的转移性非小细胞肺癌(NSCLC)
患有EGFR或ALK基因组肿瘤畸变的患者在接受尼泊洛美前,应对FDA批准的这些畸变疗法具有疾病进展
240毫克IV q2wk注入超过1小时
继续直到疾病进展或不可接受的毒性
肾细胞癌
适用于接受先前抗血管生成治疗的晚期肾细胞癌(RCC)患者
240毫克IV q2wk注入超过1小时
继续直到疾病进展或不可接受的毒性
霍奇金淋巴瘤
指示经自体造血干细胞移植(HSCT)和移植后brentuximab vedotin后复发或进展的经典霍奇金淋巴瘤(cHL)
3 mg / kg IV注入1小时q2wk,直到疾病进展或不可接受的毒性
头颈癌
适用于复发或转移性头颈部鳞状细胞癌(SCCHN),在铂类治疗后或之后发生疾病进展
3 mg / kg IV q2wk注入超过1小时
继续直到疾病进展或不可接受的毒性
尿路上皮癌
在含铂化疗期间或之后患有疾病进展的患者或在含铂化疗的新辅助治疗或辅助治疗12个月内患有疾病进展的患者中表示局部晚期或转移性尿路上皮癌
240毫克IV q2wk注入超过1小时
继续直到疾病进展或不可接受的毒性
微卫星不稳定性 - 高癌症
表明用氟嘧啶,奥沙利铂和伊立替康治疗后进行的微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)转移性结肠直肠癌
240毫克IV q2wk注入超过1小时
继续直到疾病进展或不可接受的毒性
剂量修饰
输液反应:轻度或中度反应中断或缓慢输注; 如果出现严重或危及生命的输液反应,则停药
甲状腺机能亢进或甲状腺功能亢进:无推荐剂量修饰
肾损伤:不需要剂量修改
轻度肝损伤:不需要剂量修改
中度或重度肝损伤:未研究
注意:当与ipilimumab组合使用时,如果尼非洛因被禁用,也应禁用ipilimumab
拒绝以下任何一项
-
2级肺炎
-
2级腹泻或结肠炎
-
3级腹泻或结肠炎(单剂nivolumab)
-
2级或3级垂体炎
-
2级肾上腺功能不全
-
3级高血糖症
-
脑炎,新发中度或重度神经系统症状或体征
-
3级皮疹或怀疑史蒂文森 - 约翰逊综合征(SJS)或中毒性表皮坏死松解症(TEN)
-
AST或ALT> 3-5 x ULN或总胆红素> 1.5-3 xULN
-
血清肌酐> 1.5-6 xULN或> 1.5倍基线
-
任何其他严重或3级治疗相关的不良反应
-
可能对不良反应恢复至0-1级的患者恢复治疗
永久停止以下任何操作
-
任何危及生命或4级不良反应
-
3级或4级肺炎
-
3级腹泻或结肠炎(尼泊洛美联合ipilimumab)
-
4级腹泻或结肠炎
-
4级垂体炎
-
3级或4级肾上腺功能不全
-
4级高血糖症
-
免疫介导性脑炎
-
4级皮疹或确诊为SJS或TEN
-
AST或ALT> 5 xULN或总胆红素> 3 xULN
-
血清肌酐> 6 xULN
-
任何严重或3级治疗相关的不良反应
-
在12周内无法将皮质类固醇剂量减少至≤10mg /天泼尼松或同等水平
-
持续的2级或3级治疗相关不良反应,在最后一次给药后12周内未恢复至0-1级
剂量注意事项
黑色素瘤
-
根据肿瘤反应率和反应耐久性,加快批准黑色素瘤(作为BRAF V600突变阳性或与伊曲单抗联合使用的单一药剂)的适应症。继续批准可能取决于验证试验中临床获益的验证和描述
-
关于FDA批准的用于检测NSCLC中PD-L1表达的测试的信息可以在http://www.fda.gov/CompanionDiagnostics
CHL
-
根据总体回应率,加快批准cHL批准
-
继续批准该指征可能取决于确认试验中临床获益的验证和描述
尿路上皮癌
-
根据肿瘤反应率和反应持续时间,加速批准尿路上皮癌的指征
-
继续批准该指征可能取决于确认试验中临床获益的验证和描述
MSI-H或dMMR mCRC
-
基于肿瘤反应率和反应持续时间,MSI-H或dMMR mCRC的指示被加速批准
-
继续批准该指征可能取决于确认试验中临床获益的验证和描述
孤儿名称
肝细胞癌
胶质母细胞瘤
小细胞肺癌
胃癌,包括胃食管连接癌



 添加康必行顾问,想问就问
添加康必行顾问,想问就问