当前,FDA已经批准了制药巨头默沙东旗下产品帕博利珠单抗(又称K药)与乐伐替尼(lenvatinib)联合用药用于治疗晚期子宫内膜癌。迄今为止,PD-1界的奇葩K药已被批准用于24种适应症。针对这一新适应症,要求患者没有其他有效的治疗手段并且无法接受放疗,同时没有高频微卫星不稳定(MSI-H)和错配修复缺陷(dMMR)现象。
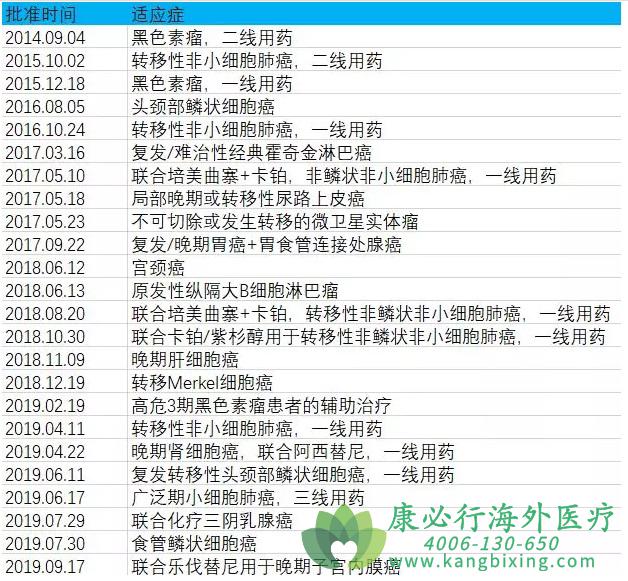
K药所有适应症及获批时间
美国、加拿大和澳大利亚三国参与了共同审评,因此,K药联合乐伐替尼治疗晚期子宫内膜癌可以在三国同时上市。令人欣慰的是,二者均已在国内批准上市,其中乐伐替尼是一款口服酪氨酸激酶抑制剂,用于一线治疗无法切除的肝细胞癌患者,人们或可期待这一联合疗法造福中国患者。
此次批准基于Ib/II期临床研究KEYNOTE-146/study 111的结果,这是一项单侧、多中心、开放标签、多队列试验。试验入组了108位患者。患者每日口服20 mg乐伐替尼,再加上每三周静脉注射200 mg帕博利珠单抗,直到疾病出现进展或者有不可耐受的不良反应。
这108位患者中间,约87%没有MSI-H和dMMR,10%有,其他为未知状态。肿瘤的MSI状态通过PCR检测,而MMR状态则通过免疫组化加以确定。
对于非MSI-H/dMMR肿瘤的患者,根据RECIST 1.1版的第三方评估结果显示,其客观缓解率(ORR)为38.3%(95%置信区间,29%-49%),完全缓解率为10.6%,27.7%的患者获得部分缓解。69%有缓解的患者的缓解持续时间达到至少6个月。
值得关注的是,此次与加拿大和澳大利亚的国际合作采用了实时肿瘤学审查(RTOR)试点计划,可以帮助在完成整个临床研究数据提交之前简化提交的数据。RTOR及其随附的评估,促进了监管机构之间的讨论,加快了三个国家的审批,同时还可以符合FDA对于安全性和有效性的高标准。此次批准相较正常的周期快了三个月。
参考资料
https://www.targetedonc.com/news/fda-approves-pembrolizumablenvatinib-for-advanced-endometrial-carcinoma
详情请访问 乐伐替尼 https://www.kangbixing.com



 添加康必行顾问,想问就问
添加康必行顾问,想问就问