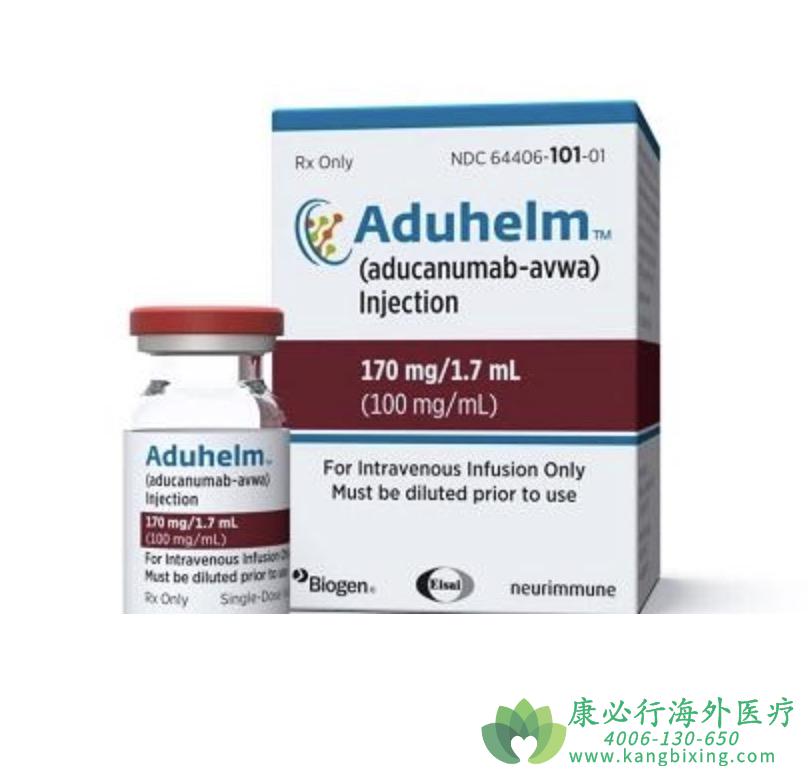
2021年6月7日,美国食品和药物管理局(FDA)批准了渤健的靶向β淀粉样蛋白的单克隆抗体阿杜那单抗,用于治疗阿尔茨海默氏症(AD)。阿杜那单抗通过加速审批程序获得批准,是自2003年以来美国FDA批准的首个治疗AD的新药。此前,FDA已授予阿杜那单抗快速通道资格(FTD)。根据加速批准条款,FDA已要求渤健开展一项新的随机对照临床试验,以验证该药物的临床疗效。如果试验未能证实临床疗效,FDA可能会启动程序撤销对该药物的批准。
阿杜那单抗(BIIB037)是一种靶向β淀粉样蛋白的在研单克隆抗体,用于早起阿尔茨海默症的治疗。该药是渤健从Neurimmune获得研发许可,2017年10月起渤健和卫材在全球合作开发和商业化阿杜那单抗。
该药上市申请的递交是基于1b 期PRIME试验、III期EMERGE试验和ENGAGE试验的数据。EMERGE(1638例患者)与ENGAGE(1647例患者)是在早期AD患者中开展的两项III期多中心、随机、双盲、安慰剂对照、平行组试验,旨在评估两种不同剂量阿杜那单抗的疗效与安全性。
临床试验达到了其主要临床终点,高剂量阿杜那单抗在78周时,与安慰剂相比,显著减缓了一种认知能力评分(CDR-SB)的降低速度(22%, p=0.01)。此外,Aducanumab在试验中还达到了多项次要终点,如MMSE(简易心智功能评估)、ADAS-Cog 13(AD评估量表-13项版本的认知子量表)和以及ADCS-ADL-MCI(AD协作研究-日常生活轻度认知障碍患者能力量表)。此外,在试验中,淀粉样蛋白斑沉积的影像检验结果显示,与安慰剂相比,低剂量与高剂量阿杜那单抗在26周和78周时均能减轻淀粉样斑块负担。
ENGAGE试验中,阿杜那单抗并没有减少临床终点指标下降,但是在事后分析中,来自暴露于高剂量阿杜那单抗的部分患者的数据支持了EMERGE的阳性发现。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:阿杜那单抗(ADUCANUMAB)疗效佳安全性高为许多患者带来了新的希望?
更多药品详情请访问 阿杜那单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问