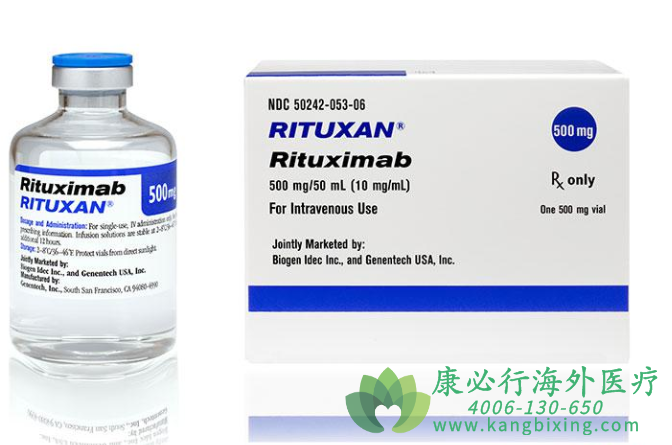
美国食品和药物管理局(FDA)近日宣布批准Rituxan Hycela(利妥昔单抗和人透明质酸酶)皮下注射用于治疗滤泡性淋巴瘤,弥漫性大B细胞淋巴瘤和慢性淋巴细胞性白血病。
该产品将CD20靶向的溶细胞抗体利妥昔单抗与透明质酸酶结合,该糖内切酶可增加皮下组织的通透性,从而增加利妥昔单抗的吸收。
在滤泡淋巴瘤(FL)治疗中,Rituxan Hycela作为复发或难治性FL单一药剂;对于以前未经治疗的FL与一线化疗相结合,以及在与化疗相结合的情况下对利妥昔单抗完全或部分反应的患者作为单一的药物维持治疗;还有对于一线环磷酰胺,长春新碱和强的松化疗后控制疾病稳定无进展的单一药物。
Rituxan Hycela还针对以前未经治疗的弥漫性大B细胞淋巴瘤与环磷酰胺,多柔比星,长春新碱,泼尼松或其他基于蒽环霉素的化疗方案的联合使用。以及以前未经治疗和预先治疗的慢性淋巴细胞性白血病与氟达拉滨和环磷酰胺联合使用。
Rituxan Hycela的批准是基于临床研究的结果,通过皮下和静脉内注射利妥昔单抗Rituxan比较其临床疗效和药代动力学。在其中一项研究中,大多数患者(77%)的Rituxan Hycel皮下给药优于静脉给药,与可以服用1.5小时或更长时间的IV输注相比,SC途径将施用时间缩短至5-7分钟。除皮肤反应外,Rituxan Hycela的不良反应的发生率和特征与Rituxan IV的相似。今天批准的Rituxan Hycela,对于三种最常见的血液癌症的患者来说又多了一种新的治疗方案,可提供与静脉注射利妥昔单抗相当的功效,并可在数分钟内递送。受益于Rituxan的人因为他们患有血液癌症可能会接受多年的反复治疗,所以减少治疗管理时间的选择可能是重要的。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 利妥昔单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问