关于膀胱癌和尿路上皮癌:据报告,全球膀胱癌每年新发病例约57.3万例,死亡21.2万例。尿路上皮癌占所有膀胱癌病例的90%,也会发生在肾盂、输尿管和尿道部位。2约有12%的病例在被发现时为局部晚期或转移性尿路上皮癌。在中国,2020年膀胱癌的发病率在所有癌症中排名第12位,据估计,2020年新发病例为85,649例。中国膀胱癌的五年患病率估计为16.26/100,000例,即235,393例。
2023年3月10日,东京和华盛顿博赛尔-安斯泰来制药集团(TSE:4503,总裁兼首席执行官:安川健司博士,“安斯泰来”)、Seagen Inc.(纳斯达克:SGEN)今日宣布,中国国家药品监督管理局(NMPA)药品审评中心(CDE)已受理恩诺单抗用于治疗既往接受过PD-1/PD-L1抑制剂和含铂化疗治疗的局部晚期或转移性尿路上皮癌(la/mUC)患者的生物制品上市许可申请(BLA)。
安斯泰来高级副总裁兼治疗领域开发负责人、医学博士、公共卫生硕士Ahsan Arozullah表示
“2020年中国新发膀胱癌病例近86,000例。我们正在与NMPA密切合作,期待尽快把这款创新药物带给中国患者。恩诺单抗目前已成为全球众多既往接受过治疗的局部晚期或转移性尿路上皮癌患者的二线和三线疗法,如顺利获批,将给中国患者带来全新的治疗选择。”
恩诺单抗的生物制品上市许可申请基于一项单臂、开放标签、多中心的II期临床试验【EV-203试验(NCT04995419)】数据。该试验旨在评估恩诺单抗治疗既往接受PD-1/PD-L1抑制剂和含铂化疗治疗的局部晚期或转移性尿路上皮癌的中国患者的疗效、安全性和药代动力学特征。结果显示,EV-203达到了其主要终点,即与历史对照相比,经独立审查委员会(IRC)确认的接受恩诺单抗单药治疗患者的客观缓解率(ORR)达到统计学意义。EV-203是EV-301试验和EV-201试验队列1的桥接试验,该研究的有效性和药代动力学数据与全球数据一致。EV-301试验是一项随机III期研究,其结果支持了恩诺单抗在全球上市许可申请的递交。
恩诺单抗单药以及与其他疗法的联合用药是一项临床开发项目的组成部分,旨在解决尿路上皮癌的全程管理,以及其他实体瘤未获满足的治疗需求。
适应症
恩诺单抗是一种Nectin-4定向抗体和微管抑制剂偶联物,适用于局部晚期或转移性尿路上皮癌成年患者,治疗先前已接受程序性死亡受体1(PD-1)抑制剂或程序性死亡配体1(PD-L1)抑制剂治疗,以及在新辅助/辅助、局部晚期或转移性环境中的含铂化疗的患者。
EV-201试验(NCT03219333)是一项针对局部晚期或转移性尿路上皮癌患者的单臂、多队列、多中心、关键性II期临床试验,入组患者既往接受PD-1或PD-L1抑制剂治疗,包括既往接受含铂化疗的患者(队列1)和未曾接受含铂化疗且顺铂不耐受的患者(队列2)。该项试验在全球多个中心招募患者,队列1患者125名,队列2患者89名。主要终点是经盲态独立中心阅片确认的客观缓解率。次要终点包括对缓解持续时间、疾病控制率、无进展生存期、总生存期、安全性和耐受性的评估。
恩诺单抗是同类首创的直接作用于Nectin-4(位于细胞表面的一种蛋白,在膀胱癌中高度表达)的一种抗体-药物偶联药物(ADC)。非临床数据显示,恩诺单抗的抗癌活性是由于其与表达Nectin-4蛋白的细胞结合,然后将抗肿瘤成分单甲基澳瑞他汀E(MMAE)内化并释放到细胞中,导致细胞停止增殖(细胞周期阻滞)和程序性细胞死亡(凋亡)。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:恩诺单抗(PADCEV/ENFORTUMAB)相关信息说明介绍
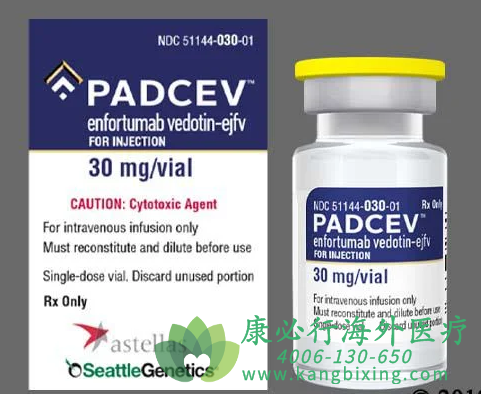
更多药品详情请访问 恩诺单抗 https://www.kangbixing.com/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问