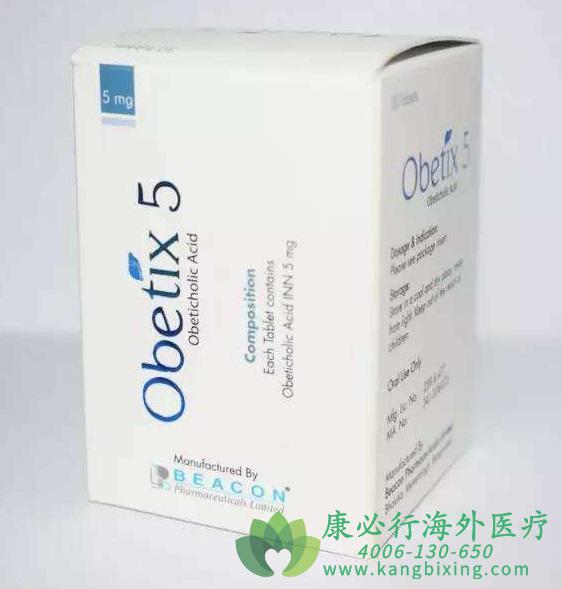
奥贝胆酸已经上市用于一种叫做原发性胆汁性肝硬化(PBC)的罕见病,但NASH是个人群更复杂、危害相对较小的疾病。PBC能用的药物不一定NASH也能用,这个产品上市四年去年销售2.5亿说明医生和NASH患者并没有太大动力标签外使用这个药物。
作为一种核受体,FXR主要分布于肝脏和小肠,在减少胆汁酸(BAs)合成与调节肝肠循环(EHC)方面起关键性作用。可是尽管如此,该药还是会产生一定的副作用。
接受奥贝胆酸治疗的患者其瘙痒症状会随着奥贝胆酸剂量的增加而加重。比如,在Ⅱ期临床试验中发现,10mg奥贝胆酸组、25mg奥贝胆酸组、50mg奥贝胆酸组和安慰剂组患者的瘙痒发生率依次为47%、87%、80%和50%。此外,研究者依据严重程度将瘙痒分为轻、中、重度。双盲实验期间,各实验组中出现重度瘙痒症状的患者比例分别为16%、24%、37%,但该比例在随后的开放式实验中呈下降趋势。
相似的,在Ⅲ期临床试验中,5~10mg奥贝胆酸组(56%)和10mg奥贝胆酸组(68%)的瘙痒发生率明显高于安慰剂组(38%)。因为无法耐受瘙痒,10%的10mg奥贝胆酸组患者退出试验,而5~10mg奥贝胆酸组为1%,安慰剂组则无人退出。在开放式实验中同样可以观察到下降的瘙痒发生率,虽然所有实验组的总瘙痒发生率升高至72%。
奥贝胆酸是个FXR激动剂,2014年ICPT宣称该药在一个283人叫做FLINT的二期临床试验中因为疗效显著而提前终止,令其股票一天之内涨了3倍。但后来才知道FLINT提前停止疗效只是一个原因,当时FDA还担心LDL升高的副作用。
次年经过和FDA、EMA的讨价还价,ICPT将奥贝胆酸推进三期临床,一级终点为同时改善纤维化和脂肪肝。因为奥贝胆酸在二期临床并未改善脂肪肝,纤维化的改善虽然达到统计显著、但和安慰剂只有0.3点区分,所以投资者对这个高标准试验并不看好、当天ICPT下滑15%。但试验开始后ICPT与FDA达成协议,两个终点只要达到一个即可上市、令成功率大增。但因为这种会议内容不会公开、FDA也不做回应,所以外界只能听厂家的一面之词,FDA有什么附加条件没人知道。当年Esperion就在FDA是否要求ETC1002做CVOT试验才能上市这个关键问题前后矛盾,令投资者一头雾水。
后来奥贝胆酸在Regenerate试验中果然只有高剂量组达到改善一级纤维化患者比例这个终点,但低剂量组未能达到统计显著区分,另一个终点缓解脂肪肝两个剂量都没有达到。虽然LDL并未成为严重问题,但显示疗效的高剂量组有51%患者出现皮肤搔痒、9%患者因此退出试验。FDA可能确实说过一个终点改善就可以上市,但和任何药物一样你得平衡风险与收益。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 奥贝胆酸 https://www.kangbixing.com/fsmy/OCALIVA/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问