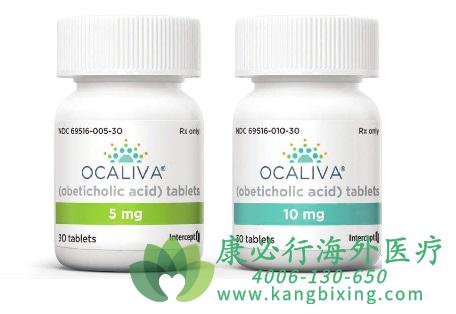
肝胆药物奥贝胆酸(obetix)简介,奥贝胆酸(Obeticholic acid,OCA,INT-747,商品名Ocaliva)是由意大利佩鲁贾(Perugia)大学最先研发,发现其化合物结构,后来授权给总部设在美国纽约市的一家生物制药公司Intercept制药公司(ICPT),随后,该公司将亚洲(包括中国、日本和韩国)的开发权授权给日本住友株式会社(Sumitomo Dainippon Pharma)。
奥贝胆酸是一种半合成的鹅去氧胆酸类似物6α-乙基鹅去氧胆酸,其是一种法尼酯X受体(Farnesoid X receptor,FXR)特异性激动剂。FXR是一种核激素受体,其配体为胆汁酸,在调节脂质和葡萄糖代谢及炎症和纤维化过程中具有关键作用。奥贝胆酸间接抑制细胞色素7A1(CYP7A1)的基因表达,抑制胆酸合成和降低静脉高压作用。作为FXR激动剂的奥贝胆酸是天然胆汁酸鹅去氧胆酸的半合成衍生物,其以更高的效力结合FXR。在肥胖动物中,奥贝胆酸治疗可显着降低高脂肪和高胆固醇喂养小鼠体重的增加和血浆葡萄糖、胆固醇、甘油三酯(TG)和脂肪酸(FA)含量;同时,奥贝胆酸能减少Zucker(fa/fa)肝脏大鼠的血脂和脂肪变性。奥贝胆酸给药显着降低了纤维生成相关蛋白(a-SMA、Col1a1、TIMP1和TIMP2)的水平,并保护雄性大鼠免受CCl4或胆管结扎(BDL)诱导的肝纤维化。奥贝胆酸给药促进CCl4和BDL诱导的纤维化模型中的肝纤维化消退。此外,奥贝胆酸治疗显着降低了由硫代乙酰胺(TAA)诱导的肝硬化大鼠的肝纤维化、炎症、血浆谷丙转氨酶(ALT)水平和肝羟脯氨酸含量。经奥贝胆酸治疗后,促纤维化细胞因子CTGF、TGF-β1和PDGFβ-R也降低。奥贝胆酸减少肝纤维化与通过上调IkBα降低NF-kB途径活性有关。奥贝胆酸于2016年5月27日由美国FDA有条件加速批准用于治疗成人原发性胆汁性胆管炎(Primarybiliary cholangitis,PBC),联合熊去氧胆酸(UDCA)用于UDCA单药治疗应答不佳的原发性胆汁性胆管炎(PBC)成人患者,或单药用于无法耐受UDCA的PBC成人患者。该适应症在2016年12月12日也获得了欧盟EMA的有条件批准。奥贝胆酸是近20年来首个获批治疗PBC的药物。由于PBC是一种罕见病,奥贝胆酸在2010年得到了欧洲药品管理局的孤儿药委员会(COMP)的孤儿药资格认定。作为激励措施,孤儿药可获得十年的市场独家经营权。FDA也已授予奥贝胆酸治疗伴有肝纤维化的非酒精性脂肪性肝炎(Nonalcoholic steatohepatitis,NASH)的突破性药物资格、治疗PBC的快速通道地位、治疗PBC和原发性硬化性胆管炎(Primary sclerosing cholangitis,PSC)的孤儿药地位。中国目前无奥贝胆酸原研和仿制药注册信息,但值得关注的是,江苏恒瑞和正大天晴仿制处于临床状态中,并进行参比制剂备案。
2017年6月22日,奥贝胆酸药物被授予2017 Premio Galeno Italia(Prix Galien Italia 2017)化学合成药物奖。Prix Galien Italia化学合成药物奖是意大利生命科学行业最受认可的荣誉之一,该奖项授予创新药物奥贝胆酸,奖励其作为PBC的新型治疗方案。
2019年2月19日,Intercept公司宣布奥贝胆酸针对伴有2~3级肝纤维化的NASH患者的关键Ⅲ期Regenerate研究的期中分析取得积极结果。该临床研究主要终点的疗效数据显示:1)奥贝胆酸25mg每日1次治疗组第18个月时,肝纤维化程度至少改善1级且NASH没有恶化的患者比例显着高于安慰剂组(分别为23.1%、11.9%,p=0.0002);2)奥贝胆酸10mg和25mg治疗组第18个月时,NASH组织病理学改善(脂肪蓄积减少)且纤维化程度没有恶化的患者比例较安慰剂组均有提高,但是在统计上没有显着差异。
安全性方面,Regenerate研究中的不良事件通常为轻至中度。最常见的不良事件与奥贝胆酸之前临床试验中的结果基本一致,主要是与剂量相关的瘙痒,在安慰剂组和奥贝胆酸10mg、25mg组的发生率分别为19%、28%和51%。大多数瘙痒事件为轻至中度,重度瘙痒在3组的发生率分别为<1%、<1%和5%。3组因为严重瘙痒而终止治疗的患者比例分别为<1%、<1%和9%。
3个治疗组的严重不良事件发生率类似(11%、11%和14%),各组未见发生率发生率超过1%的任何严重不良事件。3例患者死亡,但均与药物治疗无关。其中,安慰剂组2例分别死于骨癌和心脏停博,奥贝胆酸25mg组1例死于脑胶质瘤。
此外,奥贝胆酸治疗相关的低密度脂蛋白胆固醇(LDL-C)水平升高在Regenerate研究中也有见到,在第4周时会达到22.6mg/dL的峰值,之后会逐渐回复到18mg/dL基线水平。3组患者的严重心血管事件少见且临床表现有较大差异,发生率分别为2%、1%和2%。
奥贝胆酸是全球第一个进入Ⅲ期临床的NASH在研药物。Regenerate研究于2015年9月正式启动,是意义非常宏大的一个临床试验,原计划全球招募2500名患者,给药72周(18个月),完成入组1400例患者后进行期中分析。由于这个试验的入组和复合终点指标检测需要对患者进行肝组织活检,实施难度较大,导致患者招募迟缓,试验进度不甚理想。
2017年2月,Intercept公司宣布与FDA进行了沟通并获得了FDA的许可,将满足期中分析的患者人数条件从1400人改为750人,同时,将试验成功的标准从到达复合终点更改为只要到达其中一个终点。在试验难度降低之后,Intercept公司原本预期是2017年年中就可以进行期中分析,但直到2019年初才公布期中分析结果,这也印证了NASH新药临床试验的推进难度之大,包括患者对疾病的认知不充分,NASH药物临床试验的终点设置标准不统一等方面。
不管外部环境如何变化,奥贝胆酸终归是第一个在关键Ⅲ期研究中取得成功的NASH新药。Intercept公司计划在2019年下半年向FDA和EMA提交奥贝胆酸用于治疗NASH的新药上市申请。奥贝胆酸也是目前唯一一个被FDA授予治疗伴有肝纤维化NASH患者的突破性疗法资格的药物。
详情请访问 奥贝胆酸 https://www.kangbixing.com



 添加康必行顾问,想问就问
添加康必行顾问,想问就问