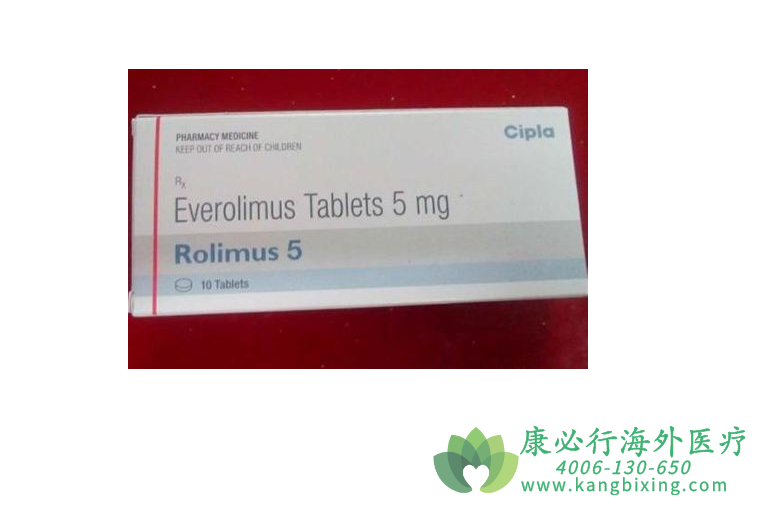
依维莫司(everolimus,EVE)为mTOR的选择性抑制剂。2009年3月30日,EVE在美国首次获得批准用于晚期肿瘤治疗,2013年1月22日在我国上市,并于2014年2月13日获得批准用于晚期胰腺神经内分泌瘤(pNET)。2016年,美国FDA和欧盟先后批准依维莫司用于不可切除、局部进展期或转移性的胃肠和肺NET.
依维莫司的国际临床研究数据和应用经验
RADIANT-3研究证实了EVE在pNET患者中的疗效。亚洲患者(安慰剂组31例,EVE组38例)亚组分析显示,中位PFS由6.37个月延长至14.09个月(HR=0.34;95%CI:0.17~0.69)。可进行RECIST评估的患者中,EVE组(n=36)75%有不同程度的肿瘤退缩,而安慰剂组(n=31)仅为35.5%。
RADIANT-4研究在晚期胃肠及肺神经内分泌瘤患者中进行,研究结果为EVE在该类患者中的治疗提供了依据。今年日本肿瘤内科学会年会(JSMO)上最新公布的RADIANT-4研究亚组分析结果显示,亚洲患者中安慰剂组(n=18)中位PFS为3.1个月,而EVE组(n=28)为11.2个月(HR=0.18;95% CI:0.09~0.38)。可进行RECIST评估的患者中,EVE组(n=25)72%有不同程度的肿瘤退缩,而安慰剂组(n=14)仅为21.4%。
两个研究中亚洲人群在中位PFS和安全性方面的数据与整体人群相似。
目前全球已有多项针对不同瘤种的临床研究证明EVE总体耐受性良好,3/4级不良反应发生率低。最常见的不良反应为口腔炎、皮疹、乏力、腹泻、感染以及代谢异常。RADIANT-3研究和RADIANT-4研究中亚洲患者的口腔炎、皮疹均高于整体人群,腹泻和乏力则低于整体人群,血糖及血脂升高在RADIANT-3研究中更为显著。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 依维莫司 https://www.kangbixing.com/bxyw/ywms/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问