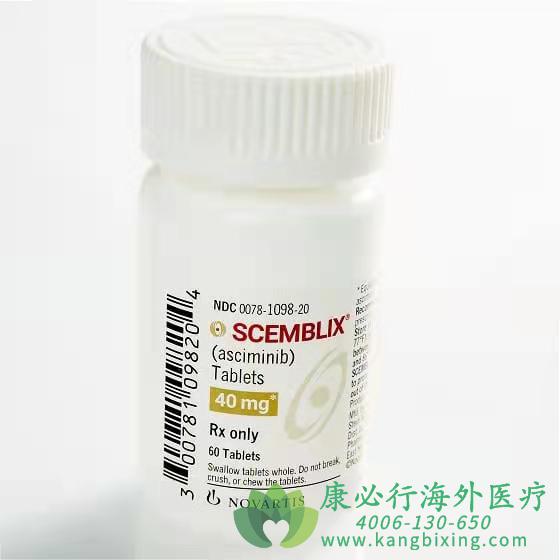
Scemblix®(Asciminib)是一种特异性靶向BCR-ABL1蛋白肉豆蔻酰口袋(STAMP)抑制剂,通过结合ABL肉豆蔻酰口袋发挥作用,能够为TKI治疗耐药和/或不耐受患者提供新的治疗手段,改善患者的预后。作为美国食品药品监督管理局批准的首个STAMP抑制剂,Scemblix®(Asciminib)用于既往接受至少两种TKI治疗的费城染色体阳性CML慢性期(Ph+CML-CP)成人患者,并完全获批用于T315I突变型Ph+CML-CP成人患者。
此次批准的依据是3期ASCEMBL试验(NCT03106779)的数据。ASCEMBL评估了Scemblix与Bosutinib在Ph阳性、慢性期CML患者中的效果,这些患者之前接受了至少2种ATP结合位点TKIs的治疗。
患者必须是至少18岁的慢性期慢性骨髓性白血病患者,在筛查时符合一定的实验室数值,并且对于那些对最近接受的TKI治疗不耐受的患者,在筛查时根据中心实验室,BCR-ABL1IS比率大于0.1%。其他纳入标准包括最近一次TKI治疗后的疾病进展或不耐受。一旦入选,患者被1:1随机分配到40毫克的Asciminib,每天两次或500毫克的Bosutinib,每天一次。港安健康国际医疗介绍,主要终点是24周的MMR。次要终点包括96周MMR、完全细胞遗传学反应(CCyR)率、MMR时间、MMR持续时间、CCyR时间、CCyR持续时间、治疗失败时间、无进展生存、总生存和安全性。
该试验显示,Scemblix引起的24周主要分子反应(MMR)率为25.5%,而Bosutinib为13.2%。此外,长期随访显示,Scemblix的96周MMR率为37.6%(95%CI,29.99%-45.65%),而Bosutinib为15.8%(95%CI,8.43%-25.96%)。在安全性方面,在接受Asciminib治疗的至少20%的患者中,最常见的任何级别的不良反应是肌肉骨骼疼痛(37.1%)、上呼吸道感染(28.1%),血小板减少(27.5%),疲劳(27.2%),头痛(24.2%),关节痛(21.6%),胰酶增加(21.3%),腹痛(21.3%),腹泻(20.5%)和恶心(20.2%)。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 Scemblix https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问