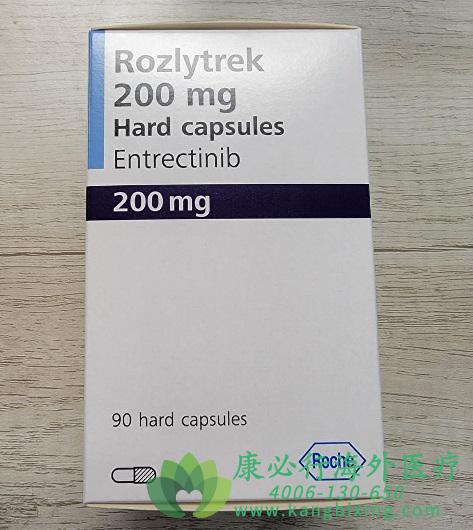
2019年8月15日,美国FDA加速批准罗氏的Rozlytrek(Entrectinib,恩曲替尼)上市,用于治疗携带神经营养因子受体酪氨酸激酶(NTRK)基因融合且没有已知获得性耐药突变的实体瘤的成人和≥12岁的儿童患者(目前尚不清楚恩曲替尼对12岁以下儿童是否安全有效)。同时,FDA还批准了Rozlytrek的第二种适应症,用于治疗携带ROS1阳性(基因重排)的转移性非小细胞肺癌患者。
恩曲替尼落地中国临床实践,惠及多种NTRK-fp实体瘤患者;NTRK-fp诊疗的第一个关键点在于检测。随着基因检测技术的发展,越来越多驱动基因被发现,尤其是NTRK等特别罕见的靶点,其融合突变没有明确的热点区域,且有很多融合伴侣,一般的传统基因检测手段无法完全覆盖。最初作为融合基因检测‘金标准’的荧光原位杂交技术(FISH)在罕见或复杂的融合基因检测上存在一定局限性,可能出现漏检,对于融合伴侣较多的NTRK-fp则可以选择二代测序(NGS)检测。DNA-NGS并不能识别所有的NTRK融合位点,容易造成漏检,临床中可以增加RNA-NGS作为补充,能有效避免漏检情况,特别对于部分复杂的融合位点,RNA-NGS也可以进一步确认。NTRK基因融合存在于多种实体瘤中。研究显示,在超过25种肿瘤中都有发现NTRK融合突变,包括甲状腺癌、结肠癌、肺癌、胰腺癌等,整体发生率约0.3%。不过,其在部分罕见癌症中,如涎腺分泌性癌(MASC)、分泌性乳腺癌、小儿纤维肌瘤、先天性肾癌等的发生率可超过90%。
此次新适应症的批准,得益于对3项单臂开放标签临床试验进行汇总分析时的积极结果。这些试验评估了ROS1阳性晚期非小细胞肺癌成人患者使用恩曲替尼治疗的效果和安全性。数据显示,73.4%(69/94)的患者使用恩曲替尼治疗达到总缓解率(ORR)。伴有中枢神经系统转移的非小细胞肺癌患者中,有一半的患者(17/34)达到颅内ORR.
2022年8月15日,罗氏(Roche)中国宣布,旗下靶向抗癌药物恩曲替尼(entrectinib)的新适应症已获得中国国家药监局(NMPA)正式批准,用于治疗ROS1阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
在中国,恩曲替尼胶囊于2022年7月29日获得NMPA首次上市批准,用于治疗NTRK融合阳性局部晚期或转移性实体瘤患者。此次则是恩曲替尼在华获批的第二个适应症,距离首个适应症获批的时间不到两周。
据悉,本次NMPA批准恩曲替尼用于治疗ROS1阳性NSCLC患者,主要依据3项1/2期临床研究(ALKA-372-001,STARTRK-1,STARTRK-2)的合并分析结果。研究结果显示,无论是否存在CNS转移,恩曲替尼的数据均显示出了有效性。
根据2022世界肺癌大会(WCLC)上公布的更新数据,在ROS1阳性NSCLC患者的一线治疗中,恩曲替尼总体客观缓解率(ORR)达68.7%,中位缓解持续时间(DOR)达35.6个月,中位无进展生存期(PFS)达17.7个月,中位总生存时间(OS)为47.7个月。同时,恩曲替尼展现了优秀的脑保护效果:经恩曲替尼治疗12个月的患者颅内转移风险仅为1%;且基线有可测量脑转移病灶的患者的颅内客观缓解率(IC-ORR)也达80.0%,表现出颅内抗肿瘤效果,而且药物安全可耐受。
罗圣全Entrectinib是一种具有中枢神经系统活性的酪氨酸激酶抑制剂(TKI),能够穿过血脑屏障,是临床上唯一一种被证明针对原发性和转移性脑疾病具有疗效的TRK抑制剂,并且没有不良的脱靶活性(Off-target activity,未达到预先设定的目标);可以阻断ROS1、ALK和NTRK激酶活性,并可能导致ROS1、ALK或NTRK基因融合的癌细胞死亡。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:罗圣全/恩曲替尼(ENTRECTINIB)对原发性和转移性中枢神经系统肿瘤患者均具有疗效?
更多药品详情请访问 恩曲替尼 https://www.kangbixing.com/drug/eqtn/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问