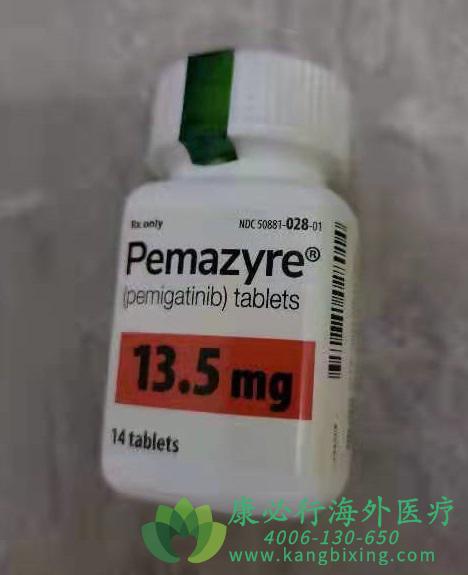
胆管癌作为一种恶性程度较高的肿瘤,其治疗长期以来面临着巨大的挑战。随着精准医疗的发展,靶向药物逐渐成为治疗胆管癌的新希望。其中,培美替尼(Pemazyre/Pemigatinib)作为首个针对胆管癌的靶向药物,其治疗FGFR2融合或重排胆管癌的效果备受关注。
培美替尼的上市与适应症
培美替尼(Pemazyre/Pemigatinib)是一种小分子激酶抑制剂,于2020年4月获得美国食品药品监督管理局(FDA)加速批准,用于治疗FGFR2基因融合/重排的经治晚期胆管癌患者。随后,在2022年4月,我国国家药品监督管理局(NMPA)也正式批准了其上市,用于治疗至少接受过一种系统性治疗,且经检测确认存在FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者。
临床试验数据
培美替尼的上市基于多项临床试验的数据支持,其中最具代表性的是FIGHT-202(NCT02924376)临床试验。该试验共纳入了146名患者,其中包括107名存在FGFR2融合/重排的患者。结果显示,在FGFR2融合/重排的患者中,培美替尼单药治疗的总缓解率为36%,其中包括2.8%的完全缓解和33%的部分缓解;疾病控制率为82%。中位缓解持续时间为9.1个月,63%的患者在6个月或更长时间内获得缓解,18%的患者在12个月或更长时间内保持缓解。
此外,另一项在中国进行的II期临床研究(CIBI375A201)也显示了培美替尼的良好疗效。该研究共纳入147名患者,结果显示在FGFR2融合/重排的患者中,客观缓解率(ORR)为37%,疾病控制率(DCR)为82.4%,中位总生存期(OS)达到了17.5个月。
安全性与不良反应
在安全性方面,培美替尼的耐受性总体良好。临床试验中最常见的不良反应包括高磷血症、脱发、腹泻、疲劳、恶心和味觉障碍等。其中,高磷血症的发生率较高,但大多数为轻至中度,且通过适当的监测和管理可以得到控制。此外,研究还未发现严重的不可控不良反应,大多数不良事件的严重程度为1级或2级。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击扩展阅读:胆管癌用药培米替尼/佩米替尼(PEMIGATINIB)的功效与毒副作用说明
更多药品详情请访问 培美替尼 https://www.kangbixing.com/drug/pmtn/




 添加康必行顾问,想问就问
添加康必行顾问,想问就问