在复发/难治性滤泡性淋巴瘤(FL)的治疗中,传统化疗与单靶点免疫疗法常因肿瘤微环境的免疫抑制与靶点逃逸陷入疗效瓶颈。这类患者历经多线治疗后,肿瘤负荷累积与免疫耗竭并存,亟需一种能突破“肿瘤-T细胞隔离”、直接激活内源性免疫清除能力的新型干预手段。莫妥珠单抗(Mosunetuzumab-axgb,商品名Lunsumio)作为全球首个获批的CD20×CD3双特异性抗体,通过桥接肿瘤B细胞与效应T细胞,将“被动靶向杀伤”转为“主动免疫激活”,为这一惰性淋巴瘤的难治人群重建治疗希望。
FL是起源于生发中心的B细胞淋巴瘤,约20%患者会进展为复发/难治性。其核心治疗难点在于:肿瘤细胞表面CD20抗原表达虽可被利妥昔单抗等单抗识别,但肿瘤微环境中的调节性T细胞(Treg)与抑制性细胞因子(如IL-10)会削弱T细胞杀伤功能;同时,多次治疗后T细胞耗竭(如PD-1/CTLA-4上调)进一步降低应答率。双特异性抗体的设计直击这一矛盾——莫妥珠单抗的一端结合FL细胞表面的CD20抗原,另一端结合T细胞表面的CD3分子,像“分子桥梁”般将T细胞物理牵引至肿瘤附近,无需预先激活即可触发T细胞受体(TCR)信号,释放穿孔素、颗粒酶B等效应分子直接裂解肿瘤细胞。这种“即插即用”的免疫激活模式,绕过了传统疗法对预存免疫的依赖。
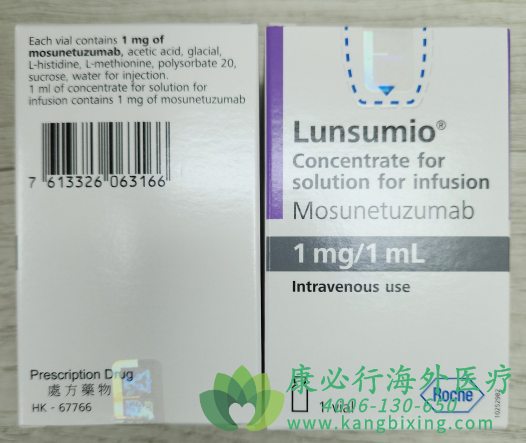
莫妥珠单抗的疗效建立在精准靶向与毒性控制的双重优化上。其IgG1骨架经工程化改造,Fc段去除了ADCC效应(避免非特异性杀伤正常B细胞),同时通过铰链区稳定化减少构象变化,延长半衰期至每三周一次给药。更重要的是,分阶段给药方案(初始低剂量递增)可诱导机体对细胞因子的适应性耐受:首次给药从1mg开始,逐步升至目标剂量,使免疫系统逐渐适应T细胞激活状态,显著降低细胞因子释放综合征(CRS)的发生率。临床前研究显示,该药对CD20低表达或经利妥昔单抗治疗后抗原丢失的FL细胞仍具活性,因其依赖T细胞的数量而非单一抗原密度,为耐药患者提供新可能。
关键II期GO29781试验纳入既往接受过至少两线治疗的复发/难治性FL患者(n=90),接受莫妥珠单抗单药治疗。结果显示,客观缓解率(ORR)达80%,其中完全缓解(CR)率60%,中位缓解持续时间(DoR)38.7个月,中位无进展生存期(PFS)22.8个月——这一数据显著优于历史单药治疗20%-40%的ORR。亚组分析发现,无论患者是否表达CD20变异体、既往是否接受过CAR-T治疗,均能观察到深度缓解,且3级以上CRS发生率仅3.3%,神经毒性(ICANS)发生率1.1%,耐受性远优于CD19×CD3双抗。更值得关注的是,约40%的CR患者在停药后2年仍维持无进展生存,提示其可能诱导持久的免疫记忆。
莫妥珠单抗适用于复发/难治性FL成人患者(经两线及以上系统治疗后进展),治疗前需通过流式细胞术确认CD20阳性,并评估T细胞数量(CD3+T细胞≥100/μL)。推荐采用“剂量递增导入期”:第1周期第1天1mg,第8天2mg,第15天60mg,后续每三周60mg维持;若出现1-2级CRS(如发热、低血压),可暂停给药并予托珠单抗干预,无需永久停药。治疗期间需每6周监测肿瘤负荷与T细胞亚群,重点关注CD8+T细胞活化标志物(如IFN-γ),若缓解后复发,可考虑与来那度胺等免疫调节剂联用重启T细胞应答。
当前探索聚焦莫妥珠单抗与免疫检查点抑制剂(如PD-1单抗)的联用,旨在解除T细胞耗竭——临床前研究显示,联合方案可将肿瘤微环境中PD-1+T细胞比例从60%降至20%,肿瘤缩小率提升30%。在边缘区淋巴瘤、套细胞淋巴瘤等其他B细胞肿瘤中的早期试验也观察到ORR达50%-70%,提示跨病种应用潜力。此外,与CAR-T序贯治疗的研究正在进行,先用莫妥珠单抗清除部分肿瘤细胞、改善肿瘤微环境,再行CAR-T输注,有望提升CAR-T的持久性。
莫妥珠单抗双特异性设计不仅破解了复发/难治患者的免疫耗竭困局,更以“分阶段激活”的安全策略平衡了疗效与毒性。随着联合方案的成熟与跨病种数据的积累,这款“T细胞激活剂”有望成为B细胞淋巴瘤免疫治疗的基石药物,让更多患者从“被动应对复发”转向“主动掌控免疫清除”。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!
更多药品详情请访问 莫妥珠单抗 https://www.kangbixing.com/



 添加康必行顾问,想问就问
添加康必行顾问,想问就问