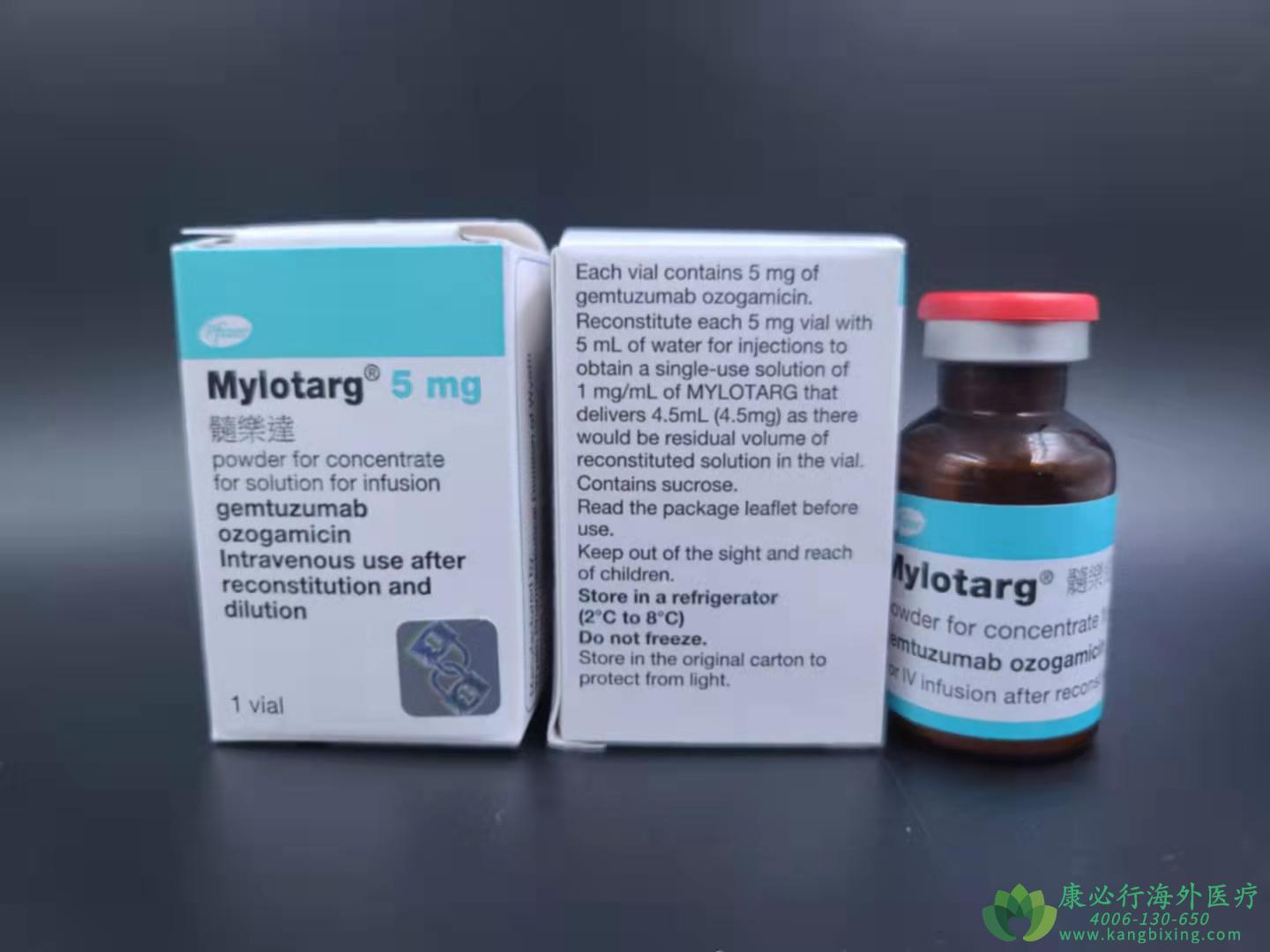
血液科病房中,一位62岁新诊断急性髓系白血病患者的骨髓报告显示CD33强阳性表达,伴随NPM1突变但无FLT3-ITD。传统"7+3"方案虽可尝试,但其合并糖尿病和轻度肝功能异常显著增加了治疗风险。这一临床困境正是吉妥珠单抗(Gemtuzumab ozogamicin)精准定位的价值所在——作为首个获批的抗体偶联药物(ADC),它不依赖广谱细胞毒性,而是将高活性DNA断裂剂卡奇霉素特异性递送至CD33阳性白血病细胞,实现靶向清除。其治疗价值在药物历经撤市与重返的曲折历程后,通过优化的分次低剂量方案得以重新确立,为特定分子亚型患者提供了生存获益与毒性平衡的新选择。
CD33(Siglec-3)在髓系白血病中的表达具有双重意义:90%以上急性髓系白血病原始细胞表面表达这一唾液酸结合免疫球蛋白样凝集素,使其成为理想靶点;但正常造血干细胞和肝细胞Kupffer细胞同样表达CD33,解释了药物脱靶毒性的根源。吉妥珠单抗的分子设计将人源化抗CD33 IgG4抗体与N-乙酰基-γ-卡奇霉素偶联,抗体结合CD33后触发受体介导内吞,溶酶体降解释放活性卡奇霉素,后者嵌入DNA小沟引发双链断裂。关键突破在于认识到:单次高剂量(9mg/m²)导致过多抗体饱和肝脏CD33,引发静脉闭塞性疾病(VOD);而分次低剂量(3mg/m²×3次)允许抗体逐步内化,显著降低肝毒性同时维持抗白血病活性。
临床应用的精准化依赖三个生物标志物分层:CD33表达强度(流式细胞术MFI大于1000最佳)、细胞遗传学风险(核心结合因子AML获益最显著)、以及UGT1A1基因型(*28/*28纯合子需谨慎)。ALFA-0701试验确立了分次给药方案的优越性:诱导期第1、4、7天给予3mg/m²,与标准化疗联用,使无事件生存期从13.6个月延长至24.3个月。更精细的亚组分析显示,CEBPA突变或NPM1突变且FLT3-ITD阴性患者5年总生存率达65%,而复杂核型患者获益有限。用药时机同样关键:诱导期早期给药(第1-3天)比巩固期给药降低37%的复发风险,提示清除初始克隆的重要性。
毒性谱的演变揭示了剂量策略的科学性。早期单次9mg/m²方案中,VOD发生率12-15%,致死率40%;现代分次方案将VOD降至2-3%,且多为轻度。但肝毒性监测仍不可或缺:治疗前需评估胆红素、ALT/AST、INR,基线铁蛋白大于1000ng/mL者风险增加;治疗中每周监测肝功能,出现右上腹痛或体重骤增需警惕VOD。骨髓抑制模式也具特征性:血小板恢复延迟1-2周,但重度感染率低于传统化疗,可能源于对髓系前体细胞的选择性作用。预防性熊去氧胆酸可降低VOD风险50%,是标准支持治疗。
吉妥珠单抗的临床定位正在从"化疗增敏剂"转向"靶向基础治疗"。新诊断老年AML(大于75岁)患者中,它与低剂量阿糖胞苷联用可将完全缓解率从23%提升至48%,且不增加早期死亡率。微小残留病(MRD)监测显示,治疗后第21天骨髓CD33+细胞清除率>90%者2年复发风险降低60%。耐药机制研究发现,CD33外显子3缺失变异导致膜表达缺失,是主要抵抗途径;而P-糖蛋白过表达则影响卡奇霉素细胞内积累。这些发现催生了新一代抗CD33药物(如vadastuximab)的设计,以及联合BCL-2抑制剂的协同策略——维奈克拉可下调MCL-1表达,增强卡奇霉素诱导的凋亡。
吉妥珠单抗的曲折历程反映了肿瘤靶向治疗的成熟轨迹:从最初追求"最大耐受剂量"的粗放模式,到如今"最佳生物效应剂量"的精准时代。它证明了药物价值并非绝对,而是取决于给药策略、患者选择和毒性管理的综合优化。更深远的意义在于,它为抗体偶联药物建立了一套从靶点验证、连接子设计到临床转化的完整范式。当新一代ADC不断涌现,吉妥珠单抗的经验提醒我们:治疗突破往往不在于发现全新靶点,而在于重新理解已知靶点的生物学内涵,并据此重塑药物应用的艺术。在白血病治疗日益细分化的今天,这一药物的重生不仅是技术胜利,更是临床智慧对简化思维的超越——真正的精准医学,始于对复杂性的敬畏与驾驭。如有需要,请咨询康必行海外医疗医学顾问:4006-130-650或扫码添加下方微信,我们将竭诚为您服务!点击拓展阅读:吉妥珠单抗/吉妥单抗(MYLOTARG)是提供靶向杀伤的新型抗体偶联药物
更多药品详情请访问 吉妥珠单抗 https://www.kangbixing.com/drug/jtzdk




 添加康必行顾问,想问就问
添加康必行顾问,想问就问