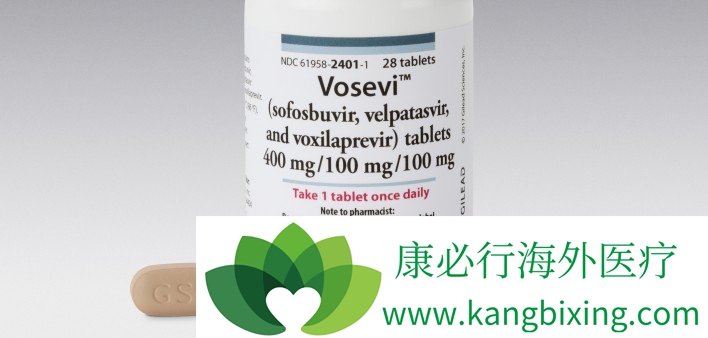
食品和药物管理局(FDA)批准了12周的吉利德科学吉四代“Vosevi”(sofosbuvir / velpatasvir / voxilaprevir),用于重新治疗所有不具有肝硬化或有补偿的丙型肝炎病毒(HCV)基因型的成年人肝硬化(较严重的肝脏疾病形式)。
更具体地,批准是针对那些先前用包含NS5A抑制剂类的直接作用抗病毒(DAA)的HCV方案治疗的基因型1,2,3,4,5或6的那些的第二次hepC治疗,或对于那些以前用含有Sovaldi(sofosbuvir)的方案治疗但不包括NS5A抑制剂的基因型1a或3的患者。
吉四代Vosevi是一种每日一次的固定片方案,其中包括聚合酶抑制剂sofosbuvir,NS5A抑制剂velpatasvir和NS3 / 4A蛋白酶抑制剂voxilaprevir。这是第一次接受以前用含有Sovaldi(sofsbuvir)治疗方案或NS5A抑制剂类药物治疗的患者。
Sovaldi也包括在吉利德的Harvoni(ledipasvir / sofosbuvir)和Epclusa(sofosbuvir / velpatasvir)中,并且可能与其他制药公司制造的药物配对,包括Bristol Myers-Squibb的Daklinza(daclatasvir)或Janssen的Olysio(simeprevir)。
批准的NS5A抑制剂包括Daklinza,Epclusa的velpatasvir组分,Harvoni的尿囊素组分,Technivie的ombitasvir组分(ombitasvir / paritaprevir / ritonavir)和Viekira方案(ombitasvir / paritaprevir / ritonavir; dasabuvir)和Zepatier的elbasvir组分(grazoprevir / elbasvir)。

FDA的批准是基于第三阶段POLARIS-1研究的数据,该研究评估了HCV基因型1至6的成年人中的12周Vosevi治疗,包括没有肝硬化的患者或补偿未经过治疗的肝硬化患者含有NS5A抑制剂的DAA方案。
批准也是基于第三阶段POLARIS-4研究的数据,该研究评估了12个月的Vosevi在成年人中没有肝硬化或补偿肝硬化的基因型1a和3,并且以前的治疗未被治愈含有Sovaldi的方案不包括NS5A抑制剂。
在POLARIS-1和-4的这些人群的汇总结果中,接受Vosevi的353人中有340人(96%)在完成治疗后12周达到持续的病毒学反应(SVR12,被认为是治愈)。
在这些试验中接受Vosevi的受试者中10%以上的受试者报告的最常见的不良健康事件是头痛,疲劳,腹泻和恶心。接受12周Vosevi的参与者中只有0.2%因为不利的健康事件而永久停止治疗。
FDA在其产品标签中给予Vosevi一项关于乙型肝炎病毒(HBV)再次激活HBV和HCV感染HBV的风险的盒装警告。该警告适用于所有DAA治疗
还有可能会导致吉四代Vosevi以及Sovaldi,Harvoni和Epclusa以及心脏药物Cordarone(胺碘酮)之间的严重反应,导致严重的,潜在的致命性疾病,称为心动过缓,或心率减慢。



 添加康必行顾问,想问就问
添加康必行顾问,想问就问